Молекулы – это каркасы всей материи, незримые строительные блоки, которые образуют все, что нас окружает. Что же делает эти микроскопические частицы таким важными? Всю интересную и загадочную работу делает притяжение, силы, которые держат молекулы вместе. Они создают основу для формирования различных веществ и определяют их физические и химические свойства.
Притяжение – это сила, которая действует между частицами, стараясь сблизить их друг с другом. В мире молекулярных соединений равновесие между силами притяжения и отталкивания определяет, насколько тесно связаны эти частицы. Поскольку все молекулы различны, они обладают различными силами притяжения, которые определяют их поведение, свойства и роль во многих процессах.
Притяжение имеет разные формы и проявления. Силы, которые действуют внутри молекулы, называются внутримолекулярным притяжением. Они могут включать химические связи, такие как ковалентные, и притяжение между атомами внутри молекулы. В то время как внутримолекулярное притяжение держит молекулу вместе, межмолекулярное притяжение действует между двумя или более молекулами. Воздействие сил притяжения определяет, какие молекулы связаны между собой и как они взаимодействуют.
Когда мы заглядываем в микромир молекул, открывается удивительная и загадочная сцена. Притяжение между молекулами диктует, как вода превращается в лед, как жидкие капли скатываются по поверхности стекла и какие ароматные молекулы делают нас безумно влюбленными в запахи. Решение загадки сцепления на микроуровне представляет собой путешествие в мир притяжения и молекулярных связей, которое подчеркивает важность этих фундаментальных объяснений в нашем мире.
Молекулы и притяжение

На микроуровне молекулы испытывают силы притяжения, которые определяют их свойства и взаимодействие с другими элементами. Эти силы, называемые межмолекулярными силами, играют ключевую роль в процессах химических реакций и обладают значительной силой притяжения на уровне атомов и молекул.
Одной из основных форм межмолекулярного притяжения является дисперсионное взаимодействие. Это слабое притяжение между молекулами, вызванное мгновенным образованием неравномерного распределения электронов в молекуле. Дисперсионные силы вносят важный вклад в свойства газов, жидкостей и твердых веществ, а также являются основой для образования молекулярных соединений.
Кроме дисперсионного взаимодействия, существуют также другие формы межмолекулярного притяжения, такие как диполь-дипольные взаимодействия и водородные связи. Диполь-дипольные силы возникают между молекулами, обладающими постоянным дипольным моментом, в результате взаимодействия положительно и отрицательно заряженных частей этих молекул. Водородные связи являются особой формой диполь-дипольных взаимодействий, возникающих между молекулами, содержащими водородную связь.
Межмолекулярные силы, в том числе дисперсионные, диполь-дипольные и водородные связи, определяют множество физических и химических свойств веществ. Например, они влияют на кипящую точку, плотность, вязкость и поверхностное натяжение вещества. Кроме того, межмолекулярные силы являются одной из причин образования кристаллических структур в твердых веществах.
Таким образом, изучение молекул и притяжения на микроуровне помогает понять основы химии и физики и объяснить множество явлений, происходящих в природе и применяемых в технологиях. Познание этих сил и их воздействия на молекулы позволяет улучшить нашу жизнь и создавать новые материалы и соединения с нужными свойствами.
Таинственное сцепление

В мире молекул и атомов все держится на сцеплении. Это явление можно сравнить с невидимыми нитями, которые удерживают все частицы вместе. Но как именно происходит это загадочное сцепление?
На микроуровне притяжение между молекулами обусловлено различными силами. Одна из основных сил - электромагнитное взаимодействие. Положительно заряженные атомы притягивают отрицательно заряженные и наоборот. Такая электрическая сила достаточно сильна, чтобы удерживать молекулы и атомы на своих местах. Но электромагнитное взаимодействие - не единственная сила, ответственная за сцепление.
Еще одна важная сила - ван-дер-ваальсова сила. Суть этой силы заключается во временном изменении заряда электронов в молекуле. В определенные моменты времени электроны располагаются ближе друг к другу, создавая временное электрическое поле. Эти временные изменения создают дополнительные притяжение между молекулами. Ван-дер-ваальсова сила является слабой, но она играет важную роль в сцеплении молекул.
Кроме электромагнитного взаимодействия и ван-дер-ваальсовой силы, существуют и другие механизмы сцепления, такие как гидрофобные связи, ионные связи и межмолекулярные взаимодействия.
Таинственное сцепление на микроуровне еще не до конца изучено. Ученые продолжают исследования в этой области, чтобы лучше понять, какие силы держат молекулы вместе и как они влияют на свойства вещества. Возможно, в процессе изучения сцепления мы сможем раскрыть новые свойства и потенциал материалов.
Силы, скрывающиеся внутри

Ответ на эти вопросы кроется в силе притяжения между атомами и молекулами внутри вещества. Эти силы могут быть слабыми или сильными, в зависимости от типа молекул и вещества.
Одной из основных сил притяжения является ван-дер-ваальсово взаимодействие, которое действует между неполярными молекулами. Это слабая сила, связанная со случайными колебаниями электронов внутри атомов и возникающая из-за временного электрического диполя, создаваемого электронами. Вода - отличный пример вещества, где ван-дер-ваальсово взаимодействие играет важную роль.
Более сильное взаимодействие можно наблюдать в полярных молекулах, где электроотрицательность одного атома создает положительный и отрицательный заряды на других атомах в молекуле. Это создает диполи, которые притягивают друг друга. Примером такого вещества является соль - ионные соединения, где положительные и отрицательные ионы притягиваются друг к другу.
Силы, скрывающиеся внутри молекул, определяют множество свойств и характеристик вещества, от его температуры плавления до его растворимости в других веществах. Изучение этих сил имеет важное значение для разработки новых материалов и прогнозирования их свойств.
- Ван-дер-ваальсово взаимодействие - слабая сила, действующая между неполярными молекулами.
- Полярные молекулы образуют сильные диполь-дипольные взаимодействия.
- Ионные соединения образуются благодаря притяжению положительных и отрицательных ионов.
Исследование сил притяжения на микроуровне помогает нам лучше понять, как работает материя и как ее свойства можно изменять. Это еще одно напоминание о том, что красота находится не только в видимых вещах, но и в силах, скрываемых внутри.
Микроуровень и химические связи
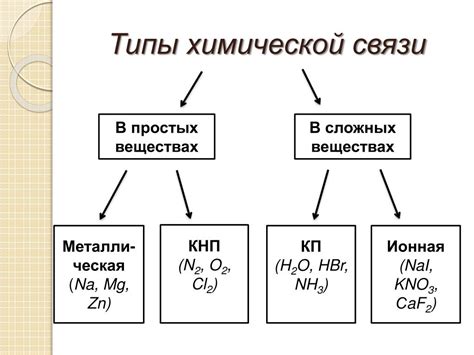
На микроуровне, молекулы состоят из атомов, которые взаимодействуют между собой через различные химические связи. Химические связи играют ключевую роль в формировании структуры и свойств веществ.
Существует несколько типов химических связей, включая ионные, ковалентные и металлические связи. Ионные связи образуются между атомами с различными зарядами, например, между металлами и неметаллами. Ковалентные связи образуются, когда атомы обменивают электроны, чтобы достичь октетного состояния. Металлические связи образуются между металлическими элементами, когда их валентные электроны свободно перемещаются по всей структуре.
Каждая из химических связей имеет свои особенности и влияет на физические и химические свойства вещества. Например, ионные соединения обычно обладают высокими температурами плавления и кипения, а также хорошими проводящими и электролитическими свойствами. В то же время, ковалентные соединения обычно обладают низкой температурой плавления и кипения и не проводят электрический ток. Металлические связи дают веществам хорошую теплопроводность и проводимость электричества.
Понимание химических связей на микроуровне позволяет исследователям разрабатывать новые материалы с определенными свойствами и применениями. Изучение молекулярной структуры и сцепления атомов может помочь в создании новых лекарственных препаратов, материалов для электроники и многих других областей науки и технологии.
Интермолекулярные силы
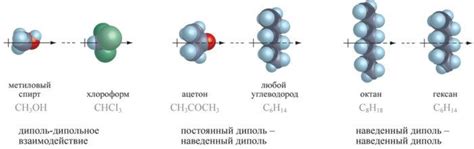
В зависимости от природы и силы взаимодействия, интермолекулярные силы могут быть разделены на несколько типов:
1. Дисперсионные силы – это слабые силы, которые возникают благодаря неравномерному распределению электронной оболочки в молекулах. Они являются самыми слабыми интермолекулярными силами, которые действуют между всеми молекулами вещества. Дисперсионные силы особенно важны для неметаллических веществ и инертных газов.
2. Диполь-дипольные силы – это силы, которые возникают между двумя молекулами с постоянным дипольным моментом. Они являются сильнее дисперсионных сил и преобладают в поларных молекулах, где имеются частично положительные и отрицательные заряды. Диполь-дипольные силы влияют на свойства молекул, например, температуру плавления и кипения.
3. Водородные связи – это особый тип диполь-дипольных сил, который возникает между молекулами, содержащими атомы водорода, связанные с электроотрицательными атомами других молекул. Водородные связи очень сильные и могут существенно влиять на свойства вещества, например, на его плотность и вязкость.
4. Йонные связи – это силы, которые возникают между ионами, т.е. молекулами с положительным и отрицательным зарядами. Йонные связи очень сильные и преобладают в ионных соединениях, таких как соли.
Интермолекулярные силы играют важную роль в химии и физике, определяя многочисленные свойства вещества, включая его плотность, теплоту, электропроводность и многое другое. Понимание и изучение этих сил позволяет лучше понять строение и поведение молекул на микроуровне.
Силы притяжения за пределами молекул
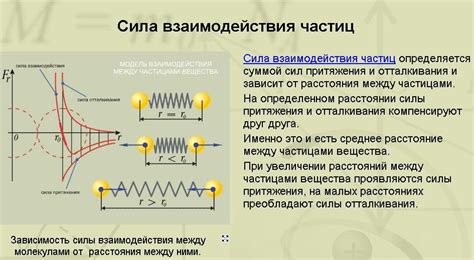
Одним из таких примеров являются силы Ван-дер-Ваальса. Эти силы возникают между атомами или молекулами и являются результатом электростатических взаимодействий между зарядами. Силы Ван-дер-Ваальса могут быть слабыми, но при большом количестве атомов или молекул они могут оказывать значительное влияние на свойства вещества.
Еще одной формой притяжения за пределами молекул являются силы гравитации. Гравитационное взаимодействие возникает между любыми двумя объектами с массой и пропорционально их массе и расстоянию между ними. Эти силы являются наиболее слабыми на микроуровне, но они играют важную роль в макромасштабных объектах, таких как планеты и звезды.
Кроме того, существуют еще много других видов притяжения за пределами молекул, таких как силы электростатического взаимодействия, магнитное взаимодействие и т.д. Эти силы могут быть как притягивающими, так и отталкивающими, и они определяют многочисленные физические явления в нашей жизни.
Исследование сил притяжения за пределами молекул имеет большое значение для понимания микро- и макроскопических свойств вещества. Оно помогает установить взаимосвязь между атомными и молекулярными уровнями организации материи и их влиянием на макромасштабные объекты и явления.
Таким образом, изучение сил притяжения за пределами молекул позволяет расширить наше представление о взаимодействиях на микроуровне и лучше понять многообразие физических явлений в природе.
Магия межатомного взаимодействия

Притяжение между атомами в молекуле обычно обусловлено электростатическими силами, направленными от частично положительного атома к частично отрицательному атому, но есть и другие, менее заметные силы, такие как ван-дер-Ваальсовы силы и водородные связи.
Ван-дер-Ваальсовы силы возникают из-за неравномерного распределения электронов в атомах и создают слабое, но все же притяжение между ними. За счет этой силы вещества способны сохранять свою фиксированную форму, как, например, в металлах и стекле.
Водородные связи - это особый тип притяжения, обусловленного положительным водородным атомом с атомом азота, кислорода или фтора, содержащим отрицательный электрический заряд. Водородные связи могут быть достаточно сильными и определяют свойства вещества, такие как температуру кипения и вязкость.
Магия межатомного взаимодействия играет решающую роль во всех аспектах нашей жизни. Она позволяет нам понимать и описывать, как вещества соединяются и образуют новые соединения, как меняют свои свойства при разных условиях. Благодаря этой магии, молекулы создают разнообразие веществ, которые окружают нас в нашей повседневной жизни.
Таблица примеров молекулярных сил и связей:
| Тип связи | Описание | Пример |
|---|---|---|
| Электростатические силы | Притяжение или отталкивание между атомами на основе их зарядов | NaCl (хлорид натрия) |
| Ван-дер-Ваальсовы силы | Слабое притяжение, вызванное временным изменением распределения электронов | Ar (аргон), H2 (молекула водорода) |
| Водородные связи | Притяжение между положительным водородным атомом и атомом другого элемента | H2O (вода) |



