Притяжение между молекулами является важным физическим явлением, которое определяет множество свойств вещества. Это притяжение обусловлено наличием электрических зарядов на разных участках молекулы и взаимодействием их электрических полей. Этот процесс называется межмолекулярным взаимодействием. Изучение причин и механизмов этого взаимодействия является важным шагом в понимании свойств вещества и может найти применение в различных областях науки и технологий.
Притяжение между молекулами может происходить по разным механизмам. Один из наиболее распространенных механизмов - диполь-дипольное взаимодействие. Оно возникает в случае, когда молекула имеет полярные связи и две молекулы с полярными связями ориентируются так, что одна полярность направлена на другую. Такое взаимодействие особенно сильно проявляется в полярных растворителях, таких как вода, и способствует растворению веществ.
Еще одним механизмом взаимодействия между молекулами является межполюсное взаимодействие. В этом случае, молекулы взаимодействуют через водородные связи или другие силы притяжения. Водородные связи возникают, когда водородная связь между молекулами образует электронное облако, что создает электростатическое притяжение. Межполюсное взаимодействие является основой межмолекулярного взаимодействия между водой и другими веществами. Кроме того, межполюсное взаимодействие также играет важную роль в биологических процессах, таких как сворачивание белков и передача сигналов в клетках.
Взаимодействие молекул вещества: причины и механизмы
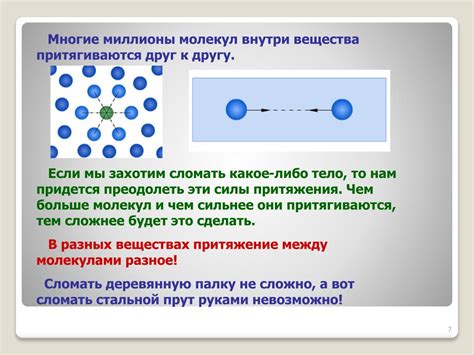
Одной из основных причин взаимодействия молекул является электростатическое притяжение. Молекулы состоят из атомов, обладающих разными зарядами – положительным и отрицательным. Заряды притягиваются друг к другу, создавая силы взаимодействия. Это основа для образования ионных связей, где электростатический притягивающий заряд одной молекулы притягивается к отрицательному заряду другой.
Кроме того, молекулы могут взаимодействовать через силы Ван-дер-Ваальса – слабые притяжения между молекулами, обусловленные временным изменением распределения электронов в атомах и молекулах. Эти слабые силы наблюдаются у всех молекул и могут притягивать их друг к другу, формируя координированные структуры.
Другой механизм взаимодействия молекул – химические связи. Они образуются, когда молекулы делят электроны, образуя пары ионов или общие пары электронов. Это явление обуславливает образование ковалентных связей, где молекулы делят электроны между собой, образуя стабильную структуру.
Таким образом, причины и механизмы взаимодействия молекул вещества включают электростатическое притяжение, силы Ван-дер-Ваальса и химические связи. Понимание этих процессов позволяет углубить наши знания о поведении вещества и применить их в различных областях науки и технологий.
Притяжение молекул: основные факторы

Первый фактор – это электростатическое притяжение. Молекулы состоят из заряженных частиц – электронов и протонов, которые создают электрическое поле вокруг себя. Если две или более молекулы имеют заряды разных знаков, они притягиваются друг к другу. Это притяжение основывается на законе Кулона и является одной из основных сил, определяющих свойства вещества.
Второй фактор – это ван-дер-ваальсово взаимодействие. В любых молекулах присутствуют электронные облака, которые не всегда равномерно распределены вокруг атомов. В результате возникают временные диполи, которые могут искажать электронное облако соседних молекул. Это создает неравномерное распределение электрического заряда в молекуле и возникающее силовое поле притягивает другие молекулы.
Третий фактор – это образование водородных связей. Водород – один из наиболее распространенных элементов вещества. Он обладает особенностью образовывать слабые связи с окружающими молекулами на основе взаимодействия водородных атомов. Эти водородные связи могут играть ключевую роль в физических свойствах молекул и соединений.
И наконец, четвертый фактор – это гидрофобные и гидрофильные взаимодействия. Некоторые молекулы обладают гидрофобными свойствами и предпочитают взаимодействовать друг с другом, игнорируя взаимодействие с водой. Другие молекулы, напротив, гидрофильные и активно взаимодействуют с водой. Эти взаимодействия определяют поведение молекул в различных средах и соединениях.
Все эти факторы взаимодействия между молекулами определяют свойства вещества, его агрегатное состояние, температуру плавления и кипения, растворимость и многое другое. Изучение механизмов притяжения молекул является важным шагом к пониманию и контролю этих свойств для различных применений в науке и технологии.
Силы взаимодействия между молекулами
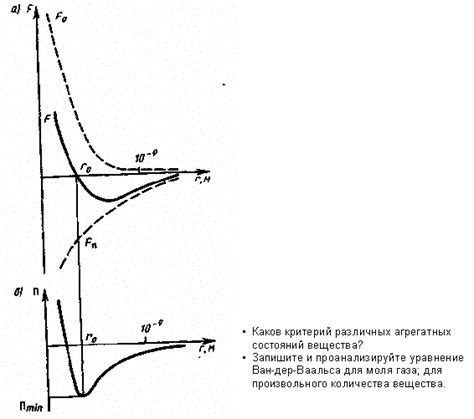
Молекулы вещества обладают свойством притягиваться друг к другу. Это явление объясняется силами взаимодействия между молекулами. Такие силы возникают вследствие различных физических и химических процессов и играют важную роль во многих аспектах нашей жизни.
Одной из основных сил взаимодействия между молекулами является сила ван-дер-Ваальса. Эта сила возникает из-за временных колебаний зарядов в молекуле, которые создают временные мнимые диполи и вызывают возникновение межмолекулярных сил притяжения. Сила ван-дер-Ваальса является слабой по сравнению с другими видами сил, но она может иметь значительное влияние на свойства вещества, такие как точка кипения, температура плавления и давление паров.
Другой важной силой взаимодействия является электростатическое взаимодействие. Оно возникает из-за притяжения или отталкивания электрических зарядов в молекулах. Если в молекуле присутствуют заряженные частицы, например, положительные и отрицательные ионы, то межмолекулярные электростатические силы приводят к их притяжению или отталкиванию. Это может влиять на свойства вещества, например, на его растворимость или проводимость.
Также следует упомянуть силы гидрофобного взаимодействия, которые возникают между неполярными молекулами в присутствии воды. Гидрофобное взаимодействие является одной из основных причин, почему неполярные молекулы не смешиваются с водой. Эта сила основана на стремлении воды образовывать максимальное количество водородных связей, что приводит к отталкиванию неполярных молекул.
Все эти силы взаимодействия между молекулами играют важную роль в природе и в технологии. Они определяют свойства вещества, его химическую активность и возможность вступать в реакции. Понимание этих сил помогает улучшить наши знания о молекулярных связях, разрабатывать новые материалы и технологии, а также прогнозировать и контролировать реакционные процессы.
Химические связи: ключевые механизмы
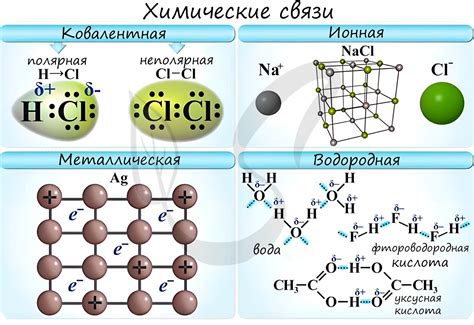
Один из ключевых механизмов химических связей – ковалентная связь. Ковалентная связь формируется при совместном использовании электронов внешней оболочки атомов. Когда два атома подключают свои оболочки, образуется общая электронная пара, которая становится связующей силой между ними. Ковалентные связи могут быть одинарными, двойными или тройными, в зависимости от количества общих электронных пар.
Ионная связь – еще один важный механизм взаимодействия между атомами. Он возникает между атомами с разными электроотрицательностями, когда атом одного элемента отдает электрон(ы), а атом другого элемента принимает их. Таким образом, образуются ионы с противоположными зарядами, которые притягиваются друг к другу. Ионные связи обладают высокой прочностью и являются причиной образования кристаллических решеток ряда веществ.
Металлическая связь – тип связи, характерный для металлов. В металлической связи свободные электроны в металлической решетке делятся между атомами, создавая общий электронный газ. Это делает металлы отличными проводниками тока и тепла.
Гидрогенная связь – слабая, но важная форма связи, которая возникает между водородом и атомами некоторых других элементов, таких как кислород, азот и фтор. Гидрогенные связи играют важную роль в структуре воды и других жидкостей, а также в формировании структуры биологических макромолекул, таких как ДНК и белки.
Все эти механизмы взаимодействия между атомами и молекулами определяют свойства и структуру вещества, его способность к реакциям и протеканию различных химических процессов. Понимание этих механизмов является важным шагом в изучении химии и помогает в создании новых материалов и соединений для различных областей промышленности и науки.
Молекулярное взаимодействие в разных веществах
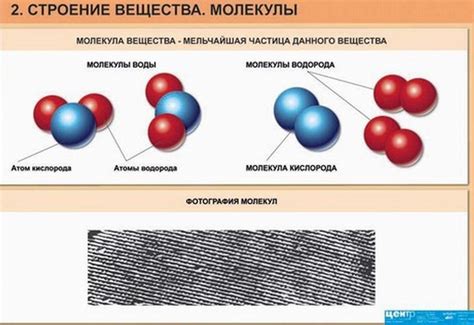
Молекулярные взаимодействия играют важную роль в поведении и свойствах веществ. Их природа и интенсивность определяют физические и химические свойства различных материалов.
Одним из видов молекулярных взаимодействий является ван-дер-ваальсово взаимодействие, которое наблюдается между не полярными молекулами. Это слабое притяжение между атомами молекулы, вызванное временными колебаниями электронной оболочки. В итоге, образуются межмолекулярные силы, отвечающие за сцепление вещества.
Для полярных веществ характерно диполь-дипольное взаимодействие. Оно возникает, когда в молекуле есть разделение зарядов, то есть присутствуют положительный и отрицательный полюса. При этом силы полярного взаимодействия существенно сильнее, чем ван-дер-ваальсовы силы притяжения.
Еще одним видом молекулярных взаимодействий являются водородные связи. Они возникают при взаимодействии молекул с интенсивными полюсами водорода. Водородная связь демонстрирует сильное электростатическое притяжение и играет значительную роль в свойствах веществ, таких как вода и многих органических соединений.
Наконец, ионы веществ образуют ионные связи, которые существуют между положительно и отрицательно заряженными ионами. Такие связи обладают высокой энергией и являются причиной образования кристаллических структур в ряде веществ, например, солей.
Роль взаимодействия молекул в природе и науке

Одним из наиболее известных молекулярных взаимодействий является взаимодействие между зарядами, которое проявляется в силе электростатического притяжения или отталкивания между заряженными частицами. Это явление объясняет, например, силу взаимодействия между атомами в молекулах и между молекулами вещества.
Взаимодействие молекул также может проявляться через другие физические силы, такие как силы Ван-дер-Ваальса или силы гидрофобного взаимодействия. Силы Ван-дер-Ваальса играют важную роль в притяжении неполярных молекул, в то время как силы гидрофобного взаимодействия приводят к образованию мембран, капель и других микроскопических структур.
Молекулярные взаимодействия имеют обширные практические применения в науке и технологии. Например, понимание взаимодействия молекул помогает химикам и инженерам разрабатывать новые материалы с желаемыми свойствами, создавать лекарственные препараты, оптимизировать процессы ферментации и катализа, а также создавать новые материалы для электроники и энергетики.
- Молекулярные взаимодействия также играют важную роль в биологических системах. Взаимодействие между молекулами белков, нуклеиновых кислот и липидов является основой для многих биологических процессов, включая сигнальные каскады, биохимические реакции и сборку клеточных структур. Понимание этих взаимодействий важно для разработки новых лекарств и терапевтических стратегий.
- Молекулярные взаимодействия могут также играть ключевую роль в экологических процессах. Например, взаимодействие между растениями и животными, а также между организмами и окружающей средой, может определять распространение видов и экосистемные функции. Изучение молекулярных взаимодействий в экологическом контексте помогает определить вклад различных факторов в жизнеспособность и устойчивость различных популяций.
Таким образом, взаимодействие молекул является фундаментальным феноменом в природе и ключевым объектом исследований в науке. Понимание механизмов и причин взаимодействия молекул позволяет не только лучше понять мир вокруг нас, но и применять этот знания для достижения различных целей в научных и практических областях.