Молекулярное взаимодействие - это ключевой процесс в мире химии, определяющий все аспекты разнообразных реакций и явлений в природе. Каждая химическая реакция основана на взаимодействии молекул, который может быть как прямым, так и косвенным. От понимания молекулярного взаимодействия зависит разработка новых лекарств, катализаторов, материалов и других важных технологий.
Принципы взаимодействия молекул базируются на идеях квантовой механики и электростатики. Молекулы могут притягиваться друг к другу или отталкиваться, в зависимости от электрических зарядов на их атомах. Электростатическое взаимодействие играет важную роль в формировании химических связей и слабых сил, таких как вани-дер-ваальсовские силы.
Другой важный механизм молекулярного взаимодействия - изменение формы идущих реакций. Когда молекулы вступают в контакт, они могут изменять свою конформацию, образуя новые связи или разрывая уже существующие. Это может привести к образованию более стабильных соединений или кинетических ингибиторов.
Молекулярное взаимодействие: механизмы и принципы
Одним из основных механизмов молекулярного взаимодействия является электростатическое взаимодействие, которое основано на притяжении или отталкивании заряженных частей молекул. В этом случае, взаимодействие молекул происходит благодаря силам Кулона. Например, положительно и отрицательно заряженные частицы могут притягиваться друг к другу, образуя ионы или молекулы с дипольным моментом.
Кроме того, взаимодействие между молекулами может осуществляться путем обмена электронами. Этот механизм называется координационной связью и является основой образования комплексных соединений. В данном случае, одна молекула (леганд) отдает пару электронов другой молекуле (лиганду), что позволяет образовать центральный атом с новой электронной конфигурацией. Это взаимодействие часто встречается в органической химии и биологических системах.
Другим важным механизмом молекулярного взаимодействия является взаимодействие Ван-дер-Ваальса. Этот тип взаимодействия связан с образованием слабых диполь-дипольных и дисперсионных сил между неполярными молекулами. Ван-дер-Ваальсовы силы проявляются благодаря взаимодействию небольших изменений зарядов в электронной оболочке атомов и молекул. Они ответственны за множество свойств веществ, таких как плотность, температура плавления и скрытая теплота испарения.
Также следует отметить механизм гидрофобного взаимодействия. Гидрофобные взаимодействия возникают между неполярными молекулами в присутствии воды. При этом, образование ограничений в движении молекул воды приводит к формированию гидрофобных объединений в водных растворах. Этот механизм взаимодействия является важным для понимания свойств белков и мембран в биологических системах.
Межмолекулярное взаимодействие: силы и электростатическая аттракция

Одной из основных сил, действующих в межмолекулярном взаимодействии, является электростатическая аттракция. Она основана на взаимодействии зарядов, возникающих из-за неравномерного распределения электронной плотности в молекуле.
Электростатическая аттракция обусловлена появлением дипольного момента в молекулах. Дипольный момент возникает, когда разность зарядов в молекуле несимметрична, что приводит к возникновению поляризации – образованию отрицательного и положительного зарядов внутри молекулы.
| Виды сил в межмолекулярном взаимодействии | Описание | Примеры веществ |
|---|---|---|
| Ван-дер-Ваальсовы силы | Слабые силы, действующие между нейтральными молекулами или атомами | Нобелевский газ, метан, гелий |
| Ионно-дипольные силы | Мощные силы, возникающие между ионами и полярными молекулами | Соляная кислота, вода, натрий хлорид |
| Диполь-дипольные силы | Силы, возникающие между полярными молекулами | Спирт, формальдегид, сахароза |
| Водородные связи | Особый тип дипольного взаимодействия, возникающий между атомом водорода и электроотрицательным атомом | Вода, молекулы аминокислот, ДНК |
Особое место в межмолекулярном взаимодействии занимают водородные связи. Они обуславливают структуру воды и большинства биологически активных веществ. Водородные связи являются наклонными и сильными, обеспечивая стабильность структурных единиц.
Таким образом, межмолекулярное взаимодействие основано на различных силах, включая электростатическую аттракцию. Эти силы определяют свойства веществ и играют важную роль во многих процессах химии и биологии.
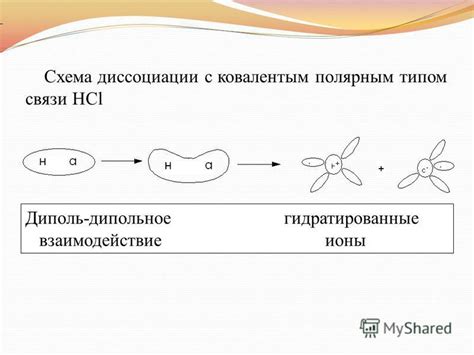
Ковалентные связи: обмен и распределение электронов
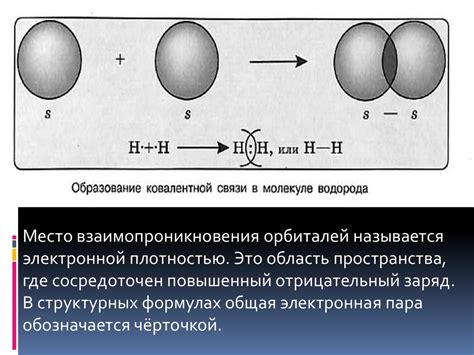
В ковалентной связи электроны, находящиеся в валентной оболочке атомов, создают общую электронную пару. Один электрон в паре принадлежит одному атому, а другой – другому атому. Таким образом, электроны в ковалентной связи разделяются между двумя атомами.
Ковалентная связь может быть одинарной, двойной или тройной, в зависимости от числа общих электронных пар между атомами. Одинарная связь образуется, когда атомы обменивают одну электронную пару. Двойная и тройная связи образуются соответственно при обмене двух и трех электронных пар.
Образование ковалентной связи происходит в результате набора и потери электронов атомами. Атомы могут набирать недостающие электроны, чтобы достичь октетной или дуплетной конфигурации электронов и стать более стабильными. При этом происходит образование зарядовых разностей между атомами, которые притягивают друг друга и формируют ковалентную связь.
Ковалентная связь является одной из наиболее прочных химических связей, что обуславливает стабильность и прочность молекул, образованных таким способом связывания атомов. Ковалентные связи могут быть однородными или неоднородными, в зависимости от того, состоят ли образующие их атомы из одного элемента или разных.
Гидрофобное взаимодействие: вода и гидратная оболочка
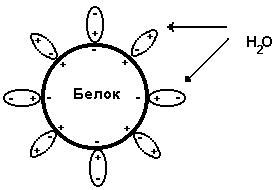
Гидрофобное взаимодействие является одним из основных факторов, определяющих структуру и свойства биологических макромолекул, таких как белки и липиды. Гидратная оболочка, образующаяся в результате гидрофобного взаимодействия, способствует стабилизации белковой структуры и обеспечивает гибкость и подвижность молекул.
Процесс образования гидратной оболочки начинается с того, что гидрофобные молекулы сгруппировываются вместе, отталкивая водные молекулы. Вода, в свою очередь, пытается минимизировать поверхностную энергию, образуя кластеры из гидратных оболочек вокруг гидрофобных молекул. Таким образом, гидрофобное взаимодействие является причиной существования устойчивых агрегатов гидрофобных молекул в водной среде.
Исследование гидрофобного взаимодействия имеет важное значение в различных областях науки и технологии, таких как фармакология, биохимия, физическая химия и многие другие. Понимание механизмов и принципов гидрофобного взаимодействия позволяет разрабатывать новые методы лечения различных заболеваний, разрабатывать новые материалы с определенными свойствами и улучшать существующие технологии.
Таким образом, гидрофобное взаимодействие является важным физическим явлением, которое оказывает значительное влияние на молекулярные взаимодействия и структуру молекул в водной среде.
Ван-дер-Ваальсово взаимодействие: индуцированная поляризация
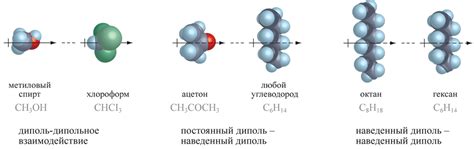
Индуцированная поляризация возникает из-за того, что электроны в молекуле постоянно движутся и создают временные флуктуации электронной плотности. В более плотных областях электронов образуется частичный отрицательный заряд, а в менее плотных областях – частичный положительный заряд. Это неравномерное распределение заряда в молекуле создает неравномерное электрическое поле, которое воздействует на соседнюю неполярную молекулу.
Когда две неполярные молекулы находятся близко друг к другу, индуцированное электрическое поле первой молекулы воздействует на электроны второй молекулы, вызывая их временную поляризацию. Это приводит к притяжению между молекулами и возникновению слабого взаимодействия, называемого ван-дер-Ваальсовым взаимодействием.
Ван-дер-Ваальсово взаимодействие важно для понимания свойств молекул и их способности образовывать агрегатные структуры, такие как газы, жидкости и твердые тела. Оно играет роль во многих процессах, включая силы сцепления между молекулами веществ, коагуляцию коллоидных частиц, адсорбцию на поверхности и взаимодействие между биологическими молекулами.
Ионно-дипольное взаимодействие: электрическое взаимодействие и положительные ионы
Положительные ионы играют важную роль в ионно-дипольном взаимодействии. Они притягиваются к отрицательным частям диполя, таким как дипольный момент молекулы или отрицательно заряженные атомы или группы атомов. Это притяжение создает электростатический потенциал, который является основным фактором, определяющим прочность ионно-дипольного взаимодействия.
Примерами ионно-дипольного взаимодействия являются взаимодействия между положительными ионами металлов и отрицательными атомами или группами атомов в молекулах соединений. Например, положительные ионы натрия (Na+) могут образовывать ионно-дипольные связи с отрицательными кислородными атомами в молекулах воды (H2O). Это объясняет, почему натрий хорошо растворяется в воде и образует ионы Na+ и OH-
Кроме того, ионно-дипольное взаимодействие важно для молекул биологически активных веществ. Например, межмолекулярные взаимодействия между положительно заряженными аминокислотными остатками в белках и отрицательными ионами в молекулах лекарственных препаратов могут играть ключевую роль в их взаимодействии и эффективности.
Таким образом, ионно-дипольное взаимодействие является важным механизмом молекулярного взаимодействия, обеспечивающим стабильность и структуру многих химических соединений и биологических молекул.
Роль гидрогенных связей в молекулярном взаимодействии: принципы и структура
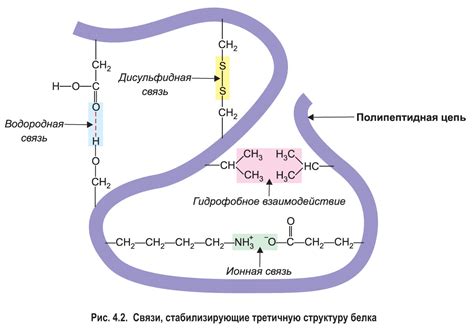
Гидрогенные связи образуются между атомами водорода и атомами кислорода, азота и фтора. Атом водорода, который является положительно заряженным, притягивается к электроотрицательному атому молекулы, создавая таким образом гидрогенную связь. Гидрогенные связи обладают высокой энергией, поэтому их образование и разрыв происходят с выделением или поглощением энергии.
Гидрогенные связи играют важную роль во многих биологических процессах. Например, вода образует гидрогенные связи между молекулами, обеспечивая уникальные физические свойства воды, такие как высокая теплоемкость и поверхностное натяжение. Гидрогенные связи также играют важную роль в структуре белков и нуклеиновых кислот, определяя их форму и функции. Благодаря гидрогенным связям молекулы воды могут образовывать тримеры или сети, что обеспечивает устойчивость структуры воды.
Гидрогенные связи также являются основой для образования двухцепочечных спиральных структур в ДНК и РНК. Гидрогенные связи своими принципами обладают высокой специфичностью. Важно отметить, что гидрогенные связи не являются постоянными, они образуются и разрываются в зависимости от окружающих условий, таких как температура и влажность.
Формирование цепочек и кластеров: комплексные интеракции молекул

Молекулы взаимодействуют друг с другом, образуя цепочки и кластеры, благодаря различным комплексным интеракциям. Комплексные интеракции молекул могут быть связаны с электростатическими силами, ван-дер-ваальсовыми взаимодействиями, водородными связями и гидрофобными взаимодействиями.
Электростатические силы возникают между заряженными частицами, например, положительными и отрицательными ионами или полярными молекулами. Они могут приводить к притяжению или отталкиванию молекул в зависимости от их зарядов и расстояния между ними.
Ван-дер-ваальсовы взаимодействия являются слабыми силами, которые возникают между неполярными молекулами. Они основаны на временных изменениях распределения электронов в молекуле, что приводит к созданию моментов диполя и взаимодействию между ними.
Водородные связи возникают между молекулами, в которых атомы водорода связаны с атомами кислорода, азота или фтора. Эти связи являются сильными и способствуют формированию устойчивых структур, таких как спиральная структура ДНК.
Гидрофобные взаимодействия происходят между неполярными частями молекул, когда они окружены водой. Неполярные молекулы стараются уйти от воды, образуя кластеры или цепочки.
Взаимодействия между молекулами играют важную роль во многих биологических процессах, таких как сворачивание белков, образование клеточных мембран и формирование молекулярных комплексов. Понимание и изучение этих комплексных интеракций позволяет лучше понять генетические процессы, взаимодействие лекарственных веществ с мишенями и многие другие аспекты химии и биологии.