Окислители и восстановители – это важные химические вещества, которые исполняют ключевую роль в процессах окисления и восстановления в живых системах. Они способны передавать электроны между другими реагентами и тем самым изменять их окислительно-восстановительный статус.
Окислительно-восстановительный (ОВП) потенциал – это мера способности вещества окислять или восстанавливаться. Он характеризуется разностью потенциалов электродов, соединенных с веществом, которое претерпевает окисление или восстановление. Измеряется в вольтах (В) и используется для определения степени активности окислителей и восстановителей в системе.
Окислители – это вещества, способные отдавать электроны, тем самым окисляя другие вещества. Они обычно являются хорошими окислителями благодаря своей способности принимать электроны, образуя ион положительного заряда или молекулярный катион. Окислители могут участвовать во многих химических реакциях, включая окислительные процессы в организме живых существ.
Восстановители – это вещества, способные принять электроны, тем самым возвращая окисленное вещество в его исходное состояние. Они играют важную роль в противопоставлении окисления и способны уменьшить количество разрушительных свободных радикалов в организме. Восстановители также используются во многих промышленных процессах и в производстве различных продуктов.
Окислитель и восстановитель в реакции окислительно восстановительного потенциала

Окислитель – это вещество, способное принимать электроны от другого вещества в реакции окисления. Окислители обладают высоким окислительным потенциалом, так как они имеют высокий аффинитет к электронам. Они могут быть органическими или неорганическими соединениями, например, перекись водорода (H2O2), феррицианид калия (K3[Fe(CN)6]) и кислород (O2).
Восстановитель – это вещество, способное отдавать электроны другому веществу в реакции восстановления. Восстановители имеют низкий окислительный потенциал, так как они имеют низкий аффинитет к электронам. Они также могут быть органическими или неорганическими, например, глюкоза (C6H12O6), аскорбиновая кислота (C6H8O6) и натрийборгидрид (NaBH4).
Окислительно-восстановительный потенциал определяется разностью окислительного и восстановительного потенциалов окислителя и восстановителя. Величина этой разности показывает, насколько сильно окислитель способен окислить восстановителя. Эта реакция становится энергетически возможной, если окислитель имеет более высокий окислительный потенциал, чем восстановитель.
Окислительно-восстановительный потенциал широко используется в химических и биологических системах, таких как электролитические процессы, энергетический обмен в клетке и синтез биологически активных молекул. Понимание роли окислителей и восстановителей в реакции ОВП помогает установить баланс между окислительными и восстановительными реакциями и поддерживать нормальное функционирование организма.
Понятие и определение
Окислительно-восстановительный потенциал (ОВП) – это мера способности вещества одновременно выполнять функции окислителя и восстановителя. ОВП измеряется в вольтах (В) или милливольтах (мВ) и является характеристикой того, насколько сильно вещество может окислить или восстановить другое вещество. Чем выше значение ОВП, тем сильнее окислительное или восстановительное действие вещества.
Окислительно-восстановительные потенциалы различных веществ могут быть измерены относительно общепринятой шкалы. Наиболее известной шкалой является стандартная водородная шкала, где ОВП водорода составляет 0 В. Определение ОВП других веществ производится путем сравнения с ОВП водорода. Величины таких относительных ОВП записываются с помощью электродной нотации, где окислитель и восстановитель указываются слева и справа от вертикальной черты.
| Вещество | Окислительно-восстановительный потенциал (ОВП), В |
|---|---|
| O2 | +1,23 |
| Fe2+ | +0,771 |
| MnO4- | +1,51 |
Как показывают данные таблицы, кислород является мощным окислителем, так как его ОВП составляет +1,23 В. В реакции окисления кислорода вода превращается в пероксид водорода. ООМ не является окислителем по сравнению с кислородом. Железо с ОВП +0,771 В превращается в двухвалентное состояние и само может выступать в качестве окислителя, а перманганат калия с ОВП +1,51 В может восстановить железо до двухвалентного состояния.
Механизмы реакции окислительно-восстановительного потенциала
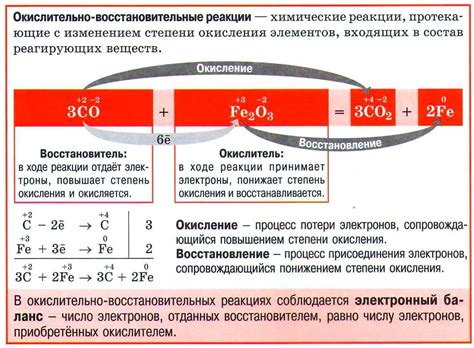
Окислительно-восстановительный потенциал (ОВП) представляет собой меру способности окислителя перенонести электроны на восстановитель в реакции окислительно-восстановительного процесса. Реакция ОВП включает в себя два основных механизма: окисление и восстановление.
Окисление представляет собой процесс потери электронов окислителем. Во время этого процесса окислитель образует положительно заряженное ионное ядро и освобождает электроны, которые передаются восстановителю. Окислившись, окислитель претерпевает структурные и химические изменения, что приводит к образованию новых веществ.
Восстановление представляет собой процесс приобретения электронов восстановителем. Во время этого процесса восстановитель принимает электроны от окислителя и осуществляет химические и структурные изменения, что приводит к формированию новых веществ.
ОБа механизма, окисление и восстановление, происходят параллельно между окислителем и восстановителем передачи электронов. При этом окисление протекает на поверхности окислителя, а восстановление на поверхности восстановителя. В результате этих процессов происходит образование окислительно-восстановительной пары, состоящей из окисленной и восстановленной формы окислителя и восстановителя.
| Механизм | Участник | Вещества | Электроны |
|---|---|---|---|
| Окисление | Окислитель | Образование новых веществ | Потеря электронов |
| Восстановление | Восстановитель | Формирование новых веществ | Приобретение электронов |
Окислительно-восстановительный потенциал является важным показателем для характеристики электрохимических реакций. Он определяет способность реакции происходить в направлении переноса электронов от окислителя к восстановителю. Значение окислительно-восстановительного потенциала зависит от многих факторов, включая природу окислителя и восстановителя, их концентрацию, температуру и другие условия эксперимента.