Оксид азота 2 (NO2) – это газообразное вещество, которое является одним из основных компонентов атмосферного загрязнения. Он образуется в результате сгорания топлива в автотранспорте, природных источников и промышленных процессов. Известно, что оксид азота 2 оказывает негативное влияние на окружающую среду и здоровье человека.
При низких температурах оксид азота 2 подвергается димеризации, то есть превращается в диоксид азота (NO2). Данный процесс протекает при низких энергетических затратах и является перспективным для утилизации оксида азота 2 в промышленных масштабах.
Димеризация оксида азота 2 происходит благодаря участию катализатора и снижению температуры. В ходе реакции одна молекула NO2 соединяется с другой молекулой NO2, образуя стабильный диоксид азота NO4.
Применение процесса димеризации оксида азота 2 имеет большой потенциал для снижения выбросов этого вредного вещества в атмосферу. Кроме того, полученный диоксид азота может использоваться в различных промышленных процессах.
Свойства оксида азота 2

Во-первых, оксид азота 2 является неорганическим соединением, которое образуется воздействием высоких температур на азот и кислород. Он представляет собой бесцветный газ с характерным запахом, который можно узнать после первого вдоха.
Во-вторых, Н2О обладает высокой растворимостью в воде, что делает его важным веществом в химической промышленности. Это свойство позволяет использовать оксид азота 2 в различных процессах и реакциях, таких как производство азотной кислоты и нитроглицерина.
В-третьих, Н2О обладает окислительными свойствами, что позволяет его использовать в процессах димеризации. Он способен взаимодействовать с другими веществами, что приводит к образованию димеров и объединению молекул. Это свойство делает Н2О важным компонентом для производства различных органических соединений, таких как аминокислоты и полимеры.
Кроме того, оксид азота 2 является нестабильным соединением, которое легко распадается под воздействием света и высоких температур. Это свойство делает его сложным для хранения и транспортировки, но одновременно открывает новые возможности для его использования в различных процессах.
Совокупность всех этих свойств делает оксид азота 2 важным веществом для многих отраслей промышленности и научных исследований. Его уникальные химические и физические свойства непрерывно привлекают внимание ученых и инженеров, что позволяет расширять сферы его применения и открывать новые горизонты.
Реакция димеризации
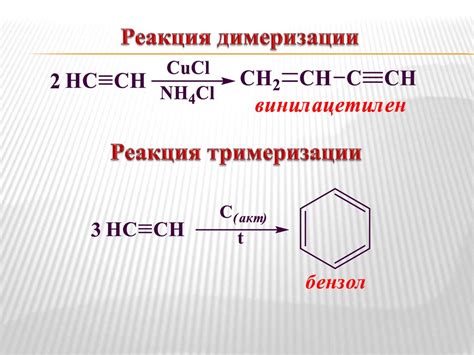
Реакция димеризации оксида азота 2 обратима и происходит при низких температурах и высоких давлениях. Для проведения данной реакции обычно используют специальные катализаторы и контролируют давление и температуру.
Димеризация оксида азота 2 является важным процессом в производстве нитриевой кислоты и других химических соединений, основанных на азоте. Также реакция димеризации применяется в различных химических синтезах и реакциях, где требуется получение N2O4 в качестве промежуточного или конечного продукта.
Влияние низких температур

Низкие температуры имеют значительное влияние на процесс димеризации оксида азота 2. При понижении температуры происходит заметное увеличение скорости реакции и образования димеров.
Снижение температуры способствует увеличению активности молекул газовых компонентов, что является одним из основных факторов, влияющих на реакцию димеризации. Уменьшение средней кинетической энергии молекул приводит к образованию более стабильных димеров.
- При низких температурах димеры оксида азота 2 образуются в большем количестве, что приводит к увеличению эффективности реакции.
- Температурные условия могут быть оптимизированы для достижения более высокой выхода димеров и повышения эффективности процесса.
- Понижение температуры также способствует уменьшению побочных реакций, что в свою очередь улучшает качество димеров.
Однако следует отметить, что слишком низкие температуры могут привести к замедлению реакции и увеличению времени ее проведения, что может оказаться нежелательным с практической точки зрения.
Таким образом, понижение температуры является важным фактором, влияющим на процесс димеризации оксида азота 2, и его оптимальный уровень может быть определен при проведении дополнительных исследований и опытных испытаний.
Механизм димеризации ОА 2

- Изначально молекулы ОА 2 свободно находятся в атмосфере и взаимодействуют с другими атомами и молекулами.
- При снижении температуры до определенного значения, реакция димеризации между двумя молекулами ОА 2 становится возможной.
- Димеризация ОА 2 происходит путем образования связи между атомами азота в каждой молекуле, образуя N2O4.
- Обратная реакция димеризации ОА 2 также возможна при повышении температуры или воздействии других факторов.
Механизм димеризации ОА 2 имеет важное значение для понимания и контроля преобразования азотных оксидов в атмосфере и их последствий для здоровья человека и окружающей среды. Изучение этого процесса позволяет разрабатывать методы и средства для снижения выбросов азотных оксидов и минимизации их негативного воздействия на окружающую среду.
Схема реакции
Реакция протекает в несколько стадий:
1. Образование радикалов NO2:
2NO2 → 2NO + O2
2. Образование димеров N2O4:
2NO + O2 → 2NO2
3. Взаимодействие NO2 и N2O4:
N2O4 + NO2 → 2NO2
В результате этих реакций димер оксида азота (N2O4) образуется быстрее, чем он диссоциирует, и сохраняется в газовой фазе.
Данный процесс имеет важное значение в атмосферной химии, так как он является ключевым элементом в формировании кислотных дождей и других загрязняющих веществ.
Участие катализаторов

Дистикселлин – это металлический катализатор, состоящий из различных металлов, таких как палладий, платина и родий. Он имеет высокую активность и стабильность, что позволяет эффективно проводить димеризацию оксида азота 2 при низких температурах.
Помимо дистикселлина, также известно использование других катализаторов, таких как оксиды металлов, наночастицы и гетерогенные металлические катализаторы. Они также способны повысить скорость и эффективность реакции димеризации оксида азота 2.
Применение оксида азота 2

Медицина: Оксид азота 2 играет важную роль в медицинской практике, особенно в анестезиологии и интенсивной терапии. Он используется для проведения общего наркоза, контроля дыхания у пациентов и расширения дыхательных путей.
Производство: Оксид азота 2 является важным промежуточным продуктом в промышленности. Он используется в процессе производства азотной кислоты, серной кислоты, азотных удобрений и других химических соединений.
Автомобильная промышленность: Оксид азота 2 является одним из важных загрязнений, образующихся в результате сгорания топлива во внутреннем сгорании двигателей. Он является основным фактором, приводящим к образованию смога и агрессивного дождя. Верные контрольные меры принимаются для снижения выбросов оксида азота 2 автомобилями.
Научные исследования: Оксид азота 2 используется в научных исследованиях, особенно в области химической кинетики и радикальной реактивности. Он играет важную роль в изучении особенностей различных химических реакций и влияет на состав и динамику атмосферы.
В целом, оксид азота 2 широко применяется в различных сферах, начиная от медицины и производства до научных исследований, и является важным химическим соединением с многообразными перспективами применения.
В медицине

Главным областью применения оксида азота 2 в медицине является его использование в анестезиологии. Он используется в смеси с кислородом для обеспечения обезболивания и обеспечения пациента комфортной среды во время операции.
Кроме того, оксид азота 2 может быть использован для лечения различных респираторных заболеваний, таких как астма и хроническая обструктивная болезнь легких (ХОБЛ). Он помогает расслабить гладкую мускулатуру бронхов, улучшая дыхательную функцию и облегчая дыхание.
Также оксид азота 2 может использоваться для лечения гипертензии легочной артерии, состояния, при котором кровь недостаточно циркулирует в сосудах легких. Он помогает расширить сосуды легких и улучшить кровоток, что может снизить симптомы и улучшить качество жизни пациентов.
Однако, как и любое лекарственное средство, оксид азота 2 имеет свои побочные эффекты и неприменим в некоторых случаях, поэтому его использование должно осуществляться только под контролем врача и с соблюдением всех рекомендаций и ограничений.
В промышленности

Одно из основных применений оксида азота 2 в промышленности - его использование в качестве антиокислителя и стабилизатора при производстве полимеров и пластмасс. Димер оксида азота (N2O4) является важным промежуточным продуктом в процессе синтеза полимеров, таких как полиуретаны и полиамиды.
Кроме того, NO2 используется как катализатор в процессе производства азотной кислоты. Димеризация оксида азота при низких температурах позволяет улучшить эффективность данного процесса и повысить выход продукта.
Для поддержания оптимальных условий димеризации оксида азота 2 в промышленных процессах применяются специальные реакционные системы, включающие катализаторы и регулирование температуры и давления.
В целом, процесс димеризации оксида азота 2 при низких температурах играет значительную роль в промышленности как в производстве полимеров, так и в химическом синтезе. Его применение позволяет получать высококачественные продукты с минимальным воздействием на окружающую среду.