Гидроксиды - это класс химических соединений, состоящих из катиона металла и гидроксильного иона (OH-). Они обладают основными свойствами, то есть могут реагировать с кислотами, образуя соль и воду.
Гидроксиды широко распространены в природе и составляют основу множества минералов. В лабораторных условиях они могут быть получены путем реакции металлического гидрооксида с кислотой или растворением металла в воде.
Главные свойства гидроксидов - их щелочные свойства. Они могут растворяться в воде и образовывать гидроксидные ионы, которые обладают способностью принимать протоны от кислот. Гидроксиды сильных оснований, таких как натриевый и гидроксид калия, являются сильными базами и образуют щелочные растворы.
Важно отметить, что не все гидроксиды являются щелочными. Некоторые гидроксиды, такие как алюминиевый гидроксид, обладают амфотерными свойствами. Это означает, что они могут реагировать как с кислотами (образуя соль и воду), так и с основаниями (образуя комплексные ионы).
Таким образом, гидроксиды являются важными соединениями в химии и имеют широкий спектр применений, начиная от использования в производстве, до медицинских исследований.
Определение и свойства гидроксидов

Одним из основных свойств гидроксидов является щелочная реакция. Они способны принимать протоны (H+) из раствора, образуя воду и противоионы (OH-). Это свойство позволяет им выступать в качестве оснований, то есть веществ, способных реагировать с кислотами и образовывать соли и воду.
Гидроксиды обладают высокой растворимостью в воде, благодаря которой они могут образовывать щелочные растворы. Растворы гидроксидов обычно имеют щелочной вкус и способны изменять цвет индикаторов, таких как фенолфталеин или лакмус.
Некоторые гидроксиды имеют амфотерные свойства, то есть они могут реагировать и с кислотами, и с основаниями. Это свойство позволяет им функционировать как универсальные реагенты и применяться в широком спектре химических реакций.
Среди наиболее известных гидроксидов можно выделить гидроксид натрия (NaOH), гидроксид кальция (Ca(OH)2) и гидроксид алюминия (Al(OH)3). Они широко применяются в промышленности, науке и повседневной жизни.
Основы гидроксидов

Гидроксиды имеют характерные физические свойства: большую растворимость в воде, образование щелочных растворов и отсутствие испарения воды при нагревании. Их структура состоит из металлической катионной сетки и аниона гидроксила, который включает один атом кислорода и один атом водорода.
Гидроксиды образуют различные кристаллические структуры, включая октаэдрические и гексагональные. Некоторые из наиболее распространенных гидроксидов включают гидроксид натрия (NaOH), гидроксид калия (KOH), гидроксид кальция (Ca(OH)2) и гидроксид алюминия (Al(OH)3).
Гидроксиды применяются в различных областях, включая производство мыла, пищевую промышленность, фармацевтику и очистку воды. Они также используются для нейтрализации кислот, а также в качестве катализаторов в реакциях окисления и гидрирования.
Важно отметить, что гидроксиды часто являются основными веществами, и их использование требует соблюдения мер предосторожности, так как они могут быть коррозивными и токсичными для организмов. При работе с гидроксидами необходимо использовать соответствующую защитную экипировку и соблюдать все нормы безопасности.
Кислоты и гидроксиды
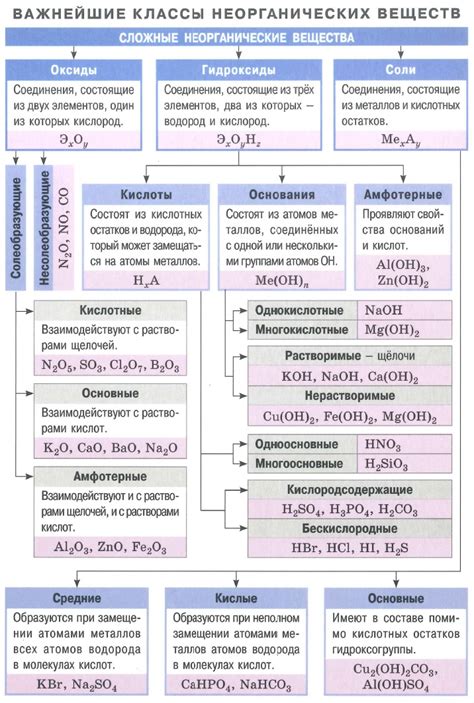
Гидроксид - это соединение, содержащее гидроксильные группы (ОН-) и способное отвечать на кислотное свойство вещества. Гидроксиды обладают щелочностью и реагируют с кислотами для образования солей и воды. Гидроксиды широко используются в различных областях, таких как производство косметических средств, пищевая промышленность и очистка воды.
Интересно, что некоторые соединения могут обладать и кислотными, и щелочными свойствами одновременно. Такие соединения называются амфотерными. Они способны реагировать как с кислотами, так и с основаниями.