Химические формулы могут казаться сложными и запутанными для непрофессионалов, но с некоторыми полезными советами и инструкциями определить кислоту по ее химической формуле может стать легче. Знание основных правил и групп кислот поможет вам разобраться в сложных формулах и идентифицировать их с легкостью.
Шаг 1: Внимательно изучите химическую формулу. Она состоит из двух частей: символа элемента и индекса. Символы элементов сокращены до букв латинского алфавита, а индексы указывают количество атомов каждого элемента в молекуле.
Пример: HCl – это хлороводородная кислота, состоящая из одного атома водорода (H) и одного атома хлора (Cl).
Шаг 2: Определите группу кислоты. Кислоты можно разделить на две основные группы: неорганические и органические. Неорганические кислоты обычно содержат в своей формуле воду и классифицируются на основе наличия гидроксильной группы (OH). Органические кислоты, с другой стороны, являются соединениями, содержащими углеродную цепь и карбоксильную группу (COOH).
Пример: H2SO4 – это неорганическая кислота серной группы, которая состоит из двух атомов водорода (H), одного атома серы (S) и четырех атомов кислорода (O).
Определение кислоты по химической формуле: простой способ и ключевые шаги
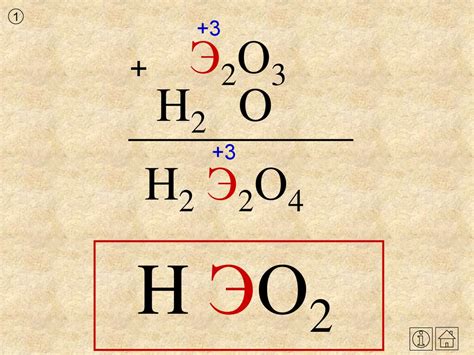
Определение кислоты по химической формуле может показаться сложным и запутанным процессом. Однако, с помощью нескольких простых шагов и ключевых правил, вы сможете легко определить любую кислоту.
Первым шагом является анализ химической формулы кислоты. Обратите внимание на наличие водорода (H) и кислорода (O) в формуле. Если в формуле присутствует только кислород, то это может быть некислотное соединение. Если кислород соединен с водородом и другими элементами, то скорее всего имеет дело с кислотой.
Далее, обратите внимание на добавочные элементы, которые присутствуют в формуле. Они могут помочь вам идентифицировать конкретную кислоту. Например, фтористоводородная кислота будет содержать фтор (F) в формуле, а серная кислота - серу (S).
Если в формуле кислоты присутствует кислород, вам необходимо определить число кислородных атомов в одной молекуле. Чтобы это сделать, обратитесь к заряду ионов воздуха (O) и гидроксония (OH). Заряд ионов воздуха будет равен -2, а заряд ионов гидроксония -1. Используя эти числа, можно рассчитать, сколько кислородных атомов присутствует в одной молекуле кислоты.
Наконец, учитывайте общие правила и конкретные свойства кислот. Например, сульфатная кислота (H2SO4) всегда будет содержать два атома водорода, один атом серы и четыре атома кислорода.
Следуя этим простым шагам и учитывая ключевые правила, вы сможете точно определить кислоту по ее химической формуле. Это поможет вам лучше понять свойства и химическую природу различных кислот.
Изучение химической формулы
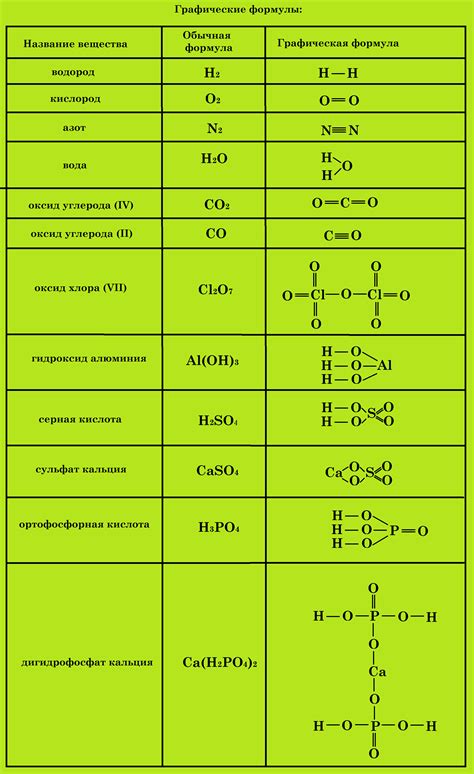
Изучение химической формулы играет важную роль в определении кислоты. Химическая формула представляет собой символьное обозначение элементов, из которых состоит кислота. Она позволяет определить, какие элементы присутствуют в кислоте и в каком количестве. Важно уметь анализировать и интерпретировать химические формулы для правильного определения кислоты.
Каждый элемент в химической формуле представляется двумя символами, причем первый символ является заглавной буквой, а второй - строчной. Химическая формула может содержать один или несколько элементов, которые разделяются между собой знаком "+". Например, в формуле HCl присутствует элемент водород (H) и элемент хлор (Cl).
| Элемент | Обозначение |
|---|---|
| Водород | H |
| Кислород | O |
| Хлор | Cl |
| Сероводород | H2S |
Количество каждого элемента указывается в нижнем индексе справа от символа элемента. Если количество равно единице, то индекс не пишется. Например, в формуле H2SO4 присутствуют два атома водорода (H), один атом серы (S) и четыре атома кислорода (O).
Исследование и анализ химической формулы помогут определить, какие элементы составляют кислоту, и проконтролировать правильность написания формулы. Это важный шаг в процессе определения кислоты по химической формуле.
Определение классификации кислоты
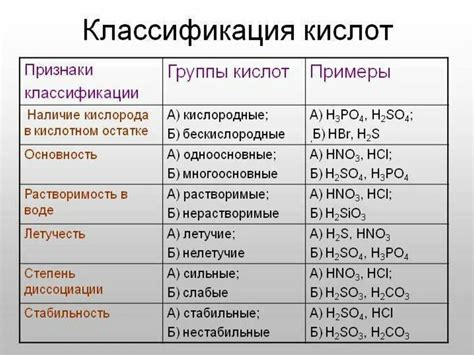
Кислоты могут быть классифицированы по различным критериям. Классификация кислоты может зависеть от их ионов, структуры и свойств.
Ионы кислоты могут быть разделены на две категории: одноосновные и двухосновные. Одноосновные кислоты содержат только один водородный ион (H+), например, HCl (хлороводородная кислота). Двухосновные кислоты содержат два водородных иона (H+), например, H2SO4 (серная кислота).
Структура кислоты может определять ее классификацию. Самая простая структура кислоты - молекула воды с добавлением одного или нескольких водородных ионов. Например, HClO (гипохлоритовая кислота) и H2SO3 (сернистая кислота) имеют структуру воды с одним водородным ионом, тогда как H2SO4 (серная кислота) имеет структуру двух молекул воды с двумя водородными ионами.
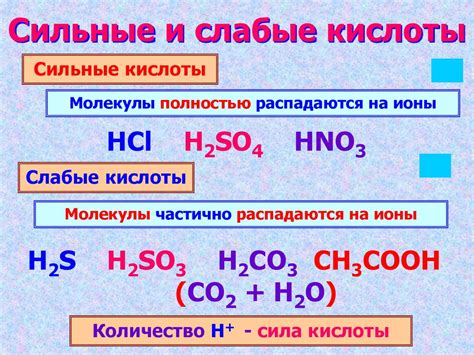
Свойства кислоты также могут указывать на ее классификацию. Одним из наиболее распространенных свойств кислоты является ее реакция с щелочью или основанием. Кислоты, которые реагируют с основаниями, называются сильными кислотами, например, соляная кислота (HCl) и серная кислота (H2SO4). Кислоты, которые слабо или не реагируют с основаниями, называются слабыми кислотами, например, органические кислоты, такие как уксусная кислота (CH3COOH).
Важно отметить, что классификация кислоты может быть более сложной и включать другие критерии, такие как ее растворимость, степень ионизации и т. д. Определение классификации кислоты требует хорошего знания химии и специальных методов анализа.
Идентификация функциональных групп

Для определения кислоты по химической формуле, необходимо обратить внимание на функциональные группы, присутствующие в молекуле. Функциональные группы могут быть определены по атомам, которые участвуют в образовании определенных связей.
Одной из наиболее распространенных функциональных групп кислот является карбоксильная группа, состоящая из кислородного и углеродного атомов с двойной связью и карбоксильной группой (-COOH). Наличие такой группы указывает на наличие карбоновой кислоты.
Еще одной распространенной функциональной группой кислоты является фосфорная группа, содержащая фосфорный и оксидный атомы, связанные с кислородом. Такие группы присутствуют, например, в фосфорной кислоте (H3PO4).
Кроме того, можно обратить внимание на наличие других групп, таких как сульфогруппы (содержащие серу), гидроксильная группа (-OH) или амино-группа (-NH2), которые могут указывать на наличие соответствующих кислот.
Важно помнить, что идентификация функциональных групп по химической формуле является лишь предварительным анализом, и для окончательного определения типа кислоты необходимо провести дополнительные химические исследования.
Определение кислотности с помощью pH-индикаторов

Для определения кислотности обычно используются pH-индикаторы в виде бумажных полосок или жидких растворов. В зависимости от pH-значения раствора, индикатор может изменяться в различные цвета, что позволяет определить степень кислотности среды. Цветовая шкала, которая соотносит цвет индикатора с определенным pH-значением, часто включена в упаковку индикатора.
Для определения кислотности с помощью pH-индикаторов необходимо:
- Приготовить раствор соединения, которое требуется проверить на кислотность.
- Нанести небольшое количество раствора на полоску pH-индикатора или добавить непосредственно в раствор индикатор в жидкой форме.
- Ожидать изменения цвета индикатора.
- Сравнить получившийся цвет с цветовой шкалой индикатора. Это позволит определить примерный pH-уровень раствора и его кислотность.
Некоторые из наиболее распространенных pH-индикаторов включают лакмусовую бумагу, фенолфталеин, метилоранж и бромоволковый синий. Каждый из этих индикаторов имеет свою уникальную цветовую шкалу и используется для определения разных интервалов pH-значений.
Использование pH-индикаторов является простым и удобным способом определения кислотности вещества. Однако следует помнить, что pH-индикаторы могут давать только приблизительные результаты, поскольку точное определение pH-значения требует использования более точных методов и оборудования.
Важно отметить, что при работе с кислотами необходимо соблюдать меры безопасности, такие как использование защитных очков и перчаток. Также следует проводить опыты в хорошо проветриваемом помещении или под вытяжкой, чтобы избежать вдыхания паров или ингаляции кислотных испарений.
Практическое определение кислоты
Для определения кислоты по ее химической формуле следует учитывать несколько факторов. Во-первых, необходимо изучить ее строение и атомный состав. Это важно, так как каждая кислота имеет свою уникальную химическую формулу, включающую в себя определенное количество атомов различных химических элементов.
Во-вторых, стоит обратить внимание на реакции, которые происходят при взаимодействии кислоты с различными веществами. К примеру, многие кислоты реагируют с металлами, выделяя газы или образуя соли. Такие реакции могут признаком наличия определенной кислоты в реакционной смеси.
Также можно использовать методы качественного и количественного анализа, такие как кислотно-основные титрования. Эти методы позволяют определить концентрацию кислоты или ее pH-значение с достаточной точностью.
Однако важно помнить, что определение кислоты по химической формуле и проведение химических реакций может быть опасным, поэтому следует обладать достаточными знаниями и опытом для безопасного проведения таких экспериментов. В случае необходимости, всегда лучше обратиться за помощью к профессионалу или использовать специальные химические реагенты и технику.