Атомы состоят из электронов, протонов и нейтронов. Внешний слой электронов, или валентная оболочка, играет важную роль в химических реакциях и связывании атомов. Понимание того, сколько электронов находится на внешнем слое, помогает установить, как атомы могут соединяться и образовывать различные соединения.
Количество электронов на внешней оболочке можно определить, исследуя расположение элементов в таблице Менделеева. У всех элементов групп А, кроме блоков s и p, внешний слой состоит из 8 электронов. Это называется правилом октета. Оболочки блоков s и p могут содержать меньше электронов, но в любом случае они заполняются по тому же принципу.
Валентные электроны, находящиеся на внешней оболочке, ответственны за химические связи. Они могут либо разделяться или принадлежать обоим связывающим атомам, образуя ковалентную связь, либо переходить полностью с одного атома на другой, образуя ионную связь. Итак, знание количества валентных электронов помогает предсказать типы химических связей, которые могут быть образованы между атомами.
Количество электронов на внешнем слое:

Чтобы определить количество электронов на внешнем слое атома в таблице Менделеева, нужно учитывать принцип заполнения оболочек.
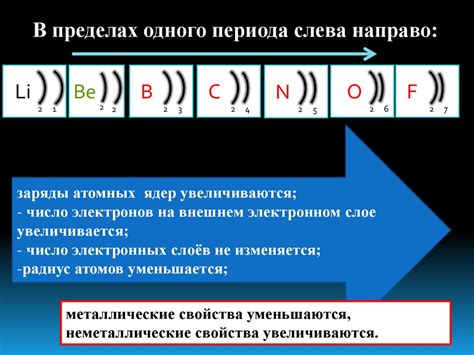
Периодическая система элементов состоит из строк (периодов) и столбцов (групп). Каждая строка элементов соответствует заполнению одной оболочки атома.
Наиболее внешняя оболочка атома называется внешним энергетическим уровнем или слоем. Количество электронов на этом уровне определяется номером группы, в которой находится элемент.
Например, элементы первой группы (литий, натрий, калий и т.д.) имеют один электрон на внешнем слое, так как они находятся в первой группе. Элементы второй группы (бериллий, магний, кальций и т.д.) имеют два электрона на внешнем слое, и так далее.
Однако, есть несколько исключений. Например, элементы восьмой группы (группа инертных газов) имеют полностью заполненную внешнюю оболочку и содержат 8 электронов на ней.
Знание количества электронов на внешнем слое помогает определить, как атом будет взаимодействовать с другими атомами и образовывать химические соединения.
Что определяет количество электронов на внешнем слое?

Количество электронов на внешнем слое атома определяется расположением этого атома в таблице Менделеева и его электронной конфигурацией. В таблице Менделеева элементы располагаются в порядке возрастания атомного номера и имеют сходные свойства в одной группе.
В каждой группе таблицы Менделеева элементы имеют одинаковое количество электронов на внешнем слое. Это количество электронов на внешнем слое, также называемое валентными электронами, определяет химические свойства элемента и его способность образовывать химические соединения.
У каждого элемента на внешнем слое может быть от одного до восьми электронов. Например, элементы в первой группе (группе 1) имеют один валентный электрон, элементы во второй группе (группе 2) имеют два валентных электрона, и так далее. Эти валентные электроны определяют, какие ионы могут образовывать элементы и их связность.
Некоторые элементы имеют валентные электроны, которые располагаются на разных оболочках. Например, элементы в третьей периоде таблицы Менделеева имеют валентные электроны на внешней оболочке, а также на предыдущей оболочке. В этом случае мы говорим об электронной конфигурации элементов.
Изучение количества электронов на внешнем слое помогает понять и предсказать химические свойства элементов и их взаимодействия с другими элементами.
Таблица Менделеева и внешний слой

Внешний слой элемента, также известный как валентная оболочка, состоит из электронной оболочки с наивысшей энергией. Количество электронов на внешнем слое определяет химические свойства элемента: его способность образовывать химические связи и реагировать с другими элементами. Элементы с одинаковым числом электронов на внешнем слое обладают схожими свойствами и относятся к одной группе периодической таблицы.
Например, у элемента натрия (Na) на внешнем слое находится один электрон, что делает его активным металлом. Этот электрон легко покидает атом натрия и участвует в химических реакциях. Другие элементы с одним электроном на внешнем слое, такие как литий (Li) и калий (K), также обладают схожими химическими свойствами.
Внешний слой также определяет важные химические свойства элементов, такие как омолаживающая и окислительная способности. На основе внешнего слоя химики могут прогнозировать, как элемент будет вести себя в химических реакциях и какие ионы он может образовывать.
Таблица Менделеева и его систематический подход к организации элементов позволяют ученым легко определять количество электронов на внешнем слое элемента и предсказывать его химические свойства на основе этой информации.
Электронные оболочки и их заполнение
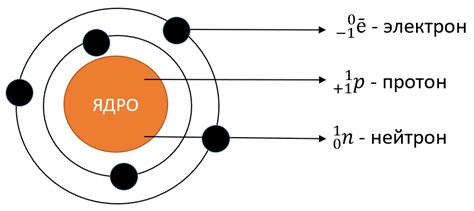
Электронные оболочки вокруг атомного ядра состоят из энергетических уровней, называемых подуровнями. Каждый подуровень имеет определенное количество электронов, которые могут находиться на нем. Энергетические уровни образуют главные квантовые числа, обозначаемые буквами K, L, M и т. д.
Принцип заполнения оболочек устанавливает, что электроны заполняют подуровни в порядке возрастания их энергии. Сначала заполняется подуровень с наименьшим энергетическим уровнем, затем следующий по возрастанию и так далее. Каждый подуровень может содержать определенное количество электронов:
- Подуровень K может содержать не более 2 электронов.
- Подуровень L может содержать не более 8 электронов.
- Подуровень M может содержать не более 18 электронов.
- Подуровень N может содержать не более 32 электронов.
Таким образом, полная электронная конфигурация атома зависит от количества электронов на его внешнем слое. Электроны на внешнем слое (валентные электроны) играют важную роль в химических реакциях и определяют химические свойства атомов.
Принцип заполнения оболочек на основе энергетических уровней
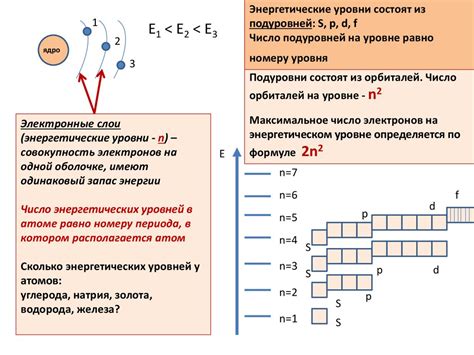
Таблица Менделеева представляет электронную структуру атома в виде периодической системы элементов. Каждый элемент представлен атомным номером, который указывает на число протонов в ядре атома. Количество электронов на внешнем слое, или валентной оболочке, может быть определено с использованием принципа заполнения оболочек.
Энергетические уровни в атоме называются s, p, d и f. Согласно принципу заполнения оболочек, s-уровень может содержать не более 2 электронов, p-уровень - не более 6 электронов, d-уровень - не более 10 электронов, а f-уровень - не более 14 электронов.
Принцип заполнения оболочек говорит о том, что электроны заполняют уровни начиная с самых низкоэнергетических. Таким образом, сначала заполняется s-уровень, затем p-уровень, и так далее. Например, валентная оболочка элемента будет содержать электроны только на самом высокоэнергетическом p-уровне, так как s-уровень будет заполнен полностью до его предела.
Принцип заполнения оболочек играет важную роль при определении химических свойств элементов. Он позволяет предсказывать, каким образом атом будет взаимодействовать с другими атомами и образовывать химические связи.
| Элемент | Атомный номер | Электронная структура |
|---|---|---|
| Кислород | 8 | 1s2 2s2 2p4 |
| Хлор | 17 | 1s2 2s2 2p6 3s2 3p5 |
| Железо | 26 | 1s2 2s2 2p6 3s2 3p6 4s2 3d6 |
Принцип заполнения оболочек позволяет получить более глубокое понимание электронной структуры атомов и их поведения в химических реакциях. Он является основным принципом в изучении атомной физики и химии.
Периодическая система элементов и расположение на внешнем слое
Расположение элементов в периодической системе позволяет нам легко определить количество электронов на внешнем слое атома элемента. Внешний слой – это электронная оболочка с наибольшим значением главного квантового числа. Количество электронов на внешнем слое можно определить по группе элемента:
- В группе 1 находятся щелочные металлы, у которых на внешнем слое всегда один электрон.
- В группе 2 находятся щелочно-земельные металлы, у которых на внешнем слое всегда два электрона.
- В группах с 13 по 18 (3-8 группы) на внешнем слое находится такое количество электронов, которое равно разности номера группы и десяти. Например, у элементов 13 группы на внешнем слое находятся три электрона.
- У элементов переходных металлов внешний слой может варьироваться от одного до двенадцати электронов, в зависимости от номера группы.
Знание количества электронов на внешнем слое позволяет предсказывать химические свойства элементов и их способность к образованию химических связей.
Связь количества электронов на внешнем слое с химической реактивностью
Количество электронов на внешнем слое атома играет важную роль в определении его химической реактивности. Внешний слой, также известный как валентная оболочка, содержит электроны, которые наиболее активно участвуют в химических реакциях.
Атомы стремятся достигнуть электронной конфигурации инертных газов, таких как гелий, неон или аргон, у которых валентная оболочка полностью заполнена. Это достигается путем установления химических связей с другими атомами, обмена или передачи электронов, чтобы достичь стабильной электронной конфигурации.
Атомы с одним-двумя электронами на внешнем слое, известные как атомы алкалийных металлов (группа 1 таблицы Менделеева), имеют тенденцию отдавать эти электроны и образовывать положительные ионы. Это позволяет им достичь стабильной оболочки. Атомы с семью электронами на внешнем слое, например атомы галогенов (группа 17), имеют тенденцию получать один электрон для достижения стабильной оболочки.
Количество электронов на внешнем слое также определяет возможность атомов образовывать химические связи или вступать в реакцию с другими атомами. Атомы с полностью заполненной валентной оболочкой, такие как инертные газы, имеют низкую реактивность, так как они уже достигли стабильной электронной конфигурации.
Следует отметить, что количество электронов на внешнем слое может быть изменено путем взаимодействия с другими атомами при химических реакциях. Это приводит к образованию ионов и созданию новых соединений.
Таким образом, количество электронов на внешнем слое таблицы Менделеева непосредственно связано с химической реактивностью атомов. Оно определяет их склонность образовывать химические связи и участвовать в химических реакциях для достижения стабильной электронной конфигурации.
Как определить количество электронов на внешнем слое?

Определение количества электронов на внешнем слое атома связано с его расположением в таблице Менделеева и принципом заполнения электронных оболочек.
В таблице Менделеева элементы расположены по возрастанию атомного номера и сгруппированы по периодам и группам. Периоды представляют собой горизонтальные строки, а группы - вертикальные столбцы.
Количество электронов на внешнем слое атома можно определить по номеру группы, в которой он находится. Если атом на внешнем слое имеет 1 - 2 электрона, то он находится в первой группе, если 13 - 18 электронов, то во второй группе.
Однако, есть исключения. Например, атомы геллия (He) и неона (Ne) на внешнем слое имеют по 2 электрона, поэтому они находятся во второй группе, а не в первой, как следовало бы по их атомным номерам.
Зная количество электронов на внешнем слое атома, можно определить его химические свойства и способность образовывать химические соединения.
Например:
У атома натрия (Na) на внешнем слое находится 1 электрон, поэтому он относится к первой группе. Это означает, что натрий легко отдает 1 электрон другому атому, чтобы образовать положительный ион.
У атома хлора (Cl) на внешнем слое находится 7 электронов, поэтому он относится к седьмой группе. Это означает, что хлор легко принимает 1 электрон от другого атома, чтобы образовать отрицательный ион.
Таким образом, определение количества электронов на внешнем слое атома позволяет понять его способность к химическим реакциям и образованию соединений.