Атомы состоят из электронов, протонов и нейтронов. Некоторые атомы имеют непарные электроны, которые влияют на их химические свойства и реактивность. Определение количества непарных электронов является важным для понимания структуры и свойств атомов.
Атомы, у которых число электронов не является круглым числом, имеют два варианта - иметь непарные электроны или образовать связи с другими атомами. Если электроны распределены таким образом, что у атома есть непарные электроны, это указывает на его химическую активность.
Определение количества непарных электронов можно выполнить с помощью модели Хюккеля. Она основана на предположении, что молекула (или ион) состоит из набора атомных орбиталей, которые могут перекрываться. Если атом имеет непарные электроны, его орбиталь будет заполнена только наполовину. Количество непарных электронов можно вычислить, используя формулу, основанную на круглых числах.
Определение количества непарных электронов может быть полезно при изучении и прогнозировании химических свойств различных соединений. Это позволяет более точно понять, как атомы будут реагировать и взаимодействовать друг с другом. Благодаря этим данным можно предсказать различные химические свойства и связи атомов, что имеет большое значение для различных областей, включая фармацевтику, материаловедение и энергетику.
Круглые числа: определение и применение

Прежде всего, круглые числа применяются в округлении других чисел. Если число оканчивается на один из цифр круглого числа, то при округлении оно будет приближено к ближайшему круглому числу. Например, число 22,4 будет округлено до 20, а число 33,9 - до 35.
Круглые числа также широко используются в различных статистических и экономических расчетах. Они позволяют упростить и ускорить вычисления, облегчая анализ данных и принятие решений. Например, при подсчете процентов или долей, круглые числа упрощают вычисления и делают результаты более понятными и удобными для использования.
Кроме того, круглые числа часто используются для определения оптимального размера группы или выборки в исследованиях. Исследователи могут стремиться выбрать такое число участников, которое будет удобно сгруппировать или обработать, и при этом сохранять достаточную точность и достоверность результатов.
Наконец, круглые числа могут использоваться в различных играх и развлечениях. Они могут быть основой для лотерейных билетов, правил расчета очков или денежных ставок. Такие числа могут быть простыми в использовании и запоминании, что делает их популярными среди игроков и любителей головоломок.
Количество валентных электронов в атоме
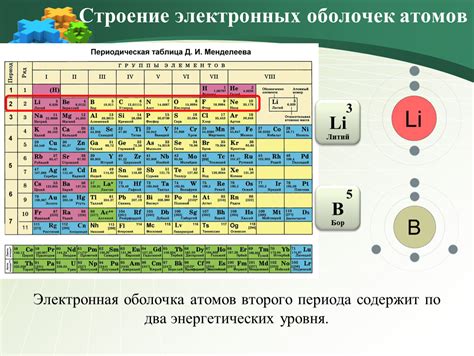
Для определения количества валентных электронов в атоме можно использовать следующий алгоритм:
- Определить атомный номер элемента. Атомный номер указывает на количество протонов и электронов в атоме.
- Определить группу элемента в периодической системе. Группа элемента указывает на количество валентных электронов.
- Если атомный номер оканчивается на 0 или 5, количество валентных электронов равно последней цифре атомного номера. Например, для атома с атомным номером 20 количество валентных электронов равно 0.
- Если атомный номер не оканчивается на 0 или 5, необходимо вычислить количество валентных электронов с помощью формулы: количество валентных электронов = последняя цифра атомного номера - (10 - группа элемента). Например, для атома с атомным номером 23 и группой элемента 5 количество валентных электронов равно 8.
Таким образом, на основе круглых чисел и знания атомного номера и группы элемента можно определить количество валентных электронов в атоме. Это важное понятие, которое помогает понять химические свойства и реактивность атома.
Взаимодействие электронов в атоме
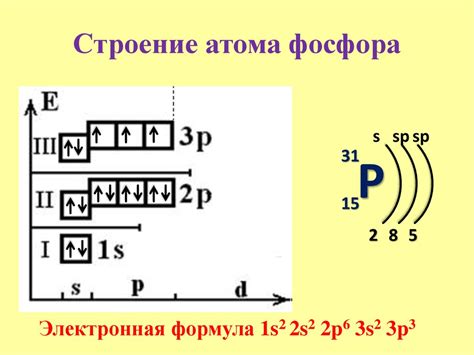
Электроны в атоме, находясь в электронных оболочках, взаимодействуют друг с другом и с ядром. Они обладают как частицами, так и волновыми свойствами, поэтому их движение и поведение в атоме определяется квантовой механикой.
Внутри атома электроны образуют электронные облака, которые наблюдаются в виде электронных оболочек или энергетических уровней. Оболочки различаются по энергии и вмещают разное количество электронов.
Взаимодействие электронов в атоме происходит посредством различных сил. Главной силой в атоме является электростатическое притяжение между электронами и положительно заряженным ядром. Также электроны в атоме взаимодействуют друг с другом посредством электростатических сил.
Электроны заполняют энергетические уровни в атоме согласно принципу электронного строения. Однако, существуют исключения для некоторых атомов, где энергетические уровни могут быть заполнены в нестандартном порядке.
Определение количества непарных электронов у атома на основе круглых чисел является одним из методов анализа электронной структуры атома. Оно позволяет определить химическую активность атома и его способность участвовать в химических реакциях.
| Электронная оболочка | Максимальное количество электронов |
|---|---|
| К-оболочка | 2 |
| Л-оболочка | 8 |
| М-оболочка | 18 |
| Н-оболочка | 32 |
Используя информацию о количестве электронов на каждой оболочке, можно определить количество непарных электронов у атома. Непарные электроны находятся на последних заполненных электронных оболочках и играют ключевую роль в химических реакциях.
Понимание взаимодействия электронов в атоме является фундаментальным для понимания химических процессов и свойств веществ. Изучение электронной структуры атомов помогает установить закономерности в периодической системе элементов и предсказывать химические свойства различных веществ.
Неупорядоченные электроны и их химическая активность
Количество неупорядоченных электронов у атома определяет его готовность к образованию химических связей. Атомы с одним или тремя неупорядоченными электронами часто проявляют высокую химическую активность, так как они стремятся завершить свою последнюю энергетическую оболочку, чтобы достичь стабильности. Атомы с полностью заполненной последней оболочкой имеют малую химическую активность, так как они уже достигли стабильной конфигурации и не нуждаются в дополнительных электронах.
Неупорядоченные электроны также играют важную роль в образовании ионов. Атомы с неполной внешней энергетической оболочкой могут получать или терять электроны, чтобы достичь оболочки с полным или полностью заполненным набором электронов. Это приводит к образованию катионов (атомы с положительным зарядом) или анионов (атомы с отрицательным зарядом). Ионная химия основана на взаимодействии атомов с неупорядоченными электронами, и ионы играют важную роль во многих химических реакциях и процессах.
Таким образом, понимание количества и роли неупорядоченных электронов у атома является ключевым фактором для понимания его химической активности и его способности образовывать связи с другими атомами. Это знание играет важную роль во многих аспектах химии, от образования соединений до понимания реакций и механизмов химических процессов.
Теория заполнения энергетических уровней
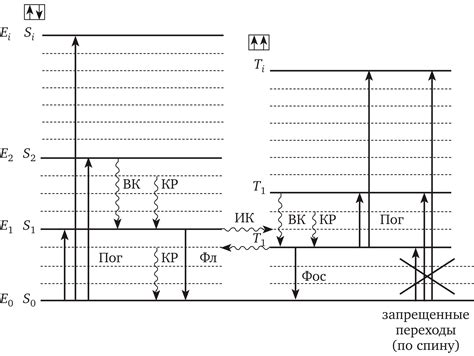
Согласно этой теории, энергетические уровни атома разделяются на подуровни, которые в свою очередь могут содержать разное количество орбиталей. Каждая орбиталь может содержать до двух электронов, принадлежащих разным спинам.
Порядок заполнения энергетических уровней в атоме определяется принципом Максвелла (или также известным как принцип заполнения): сначала заполняются энергетические уровни с наименьшей энергией, а затем электроны начинают заполнять уровни с более высокой энергией.
Также существует правило полной заполненности, согласно которому энергетические уровни заполняются по возрастанию. Например, электроны будут заполнять первый энергетический уровень, затем второй, третий и так далее.
Количество электронов на каждом энергетическом уровне может быть определено на основе круглых чисел. Если электроны находятся в скрытых орбиталях, их энергетический уровень будет закрыт, и электроны на этом уровне будут непарными.
Таким образом, теория заполнения энергетических уровней является фундаментальной для понимания структуры атомов и молекул и имеет широкое применение в химии, физике и материаловедении.
Модель Ханта
Основная идея модели Ханта заключается в том, что элементы в периодической таблице расположены в порядке увеличения номеров атомных орбиталей, а количество непарных электронов в атоме определяется как разность между числом электронов на последней заполненной орбитали и числом электронов на следующей орбитали.
Например, для атома азота (N) на последней заполненной орбитале находятся 2 электрона, а на следующей орбитали - 5 электронов. Рассчитывается разность: 5 - 2 = 3. Таким образом, атом азота имеет 3 непарных электрона.
Модель Ханта является очень полезным инструментом для анализа атомных свойств и соединений, так как количество непарных электронов влияет на реакционную способность и химические свойства вещества.
Практическое применение определения непарных электронов

Определение количества непарных электронов у атома может иметь практическое применение в различных научных и технических областях.
Например, в химии количество непарных электронов у атома может служить основой для определения его химических свойств. Знание количества непарных электронов позволяет предсказать, как будет происходить химическая реакция и какие соединения могут образоваться. Таким образом, определение непарных электронов является важным инструментом в изучении химических процессов и разработке новых соединений.
Также определение непарных электронов находит применение в физике и материаловедении. Количество непарных электронов может влиять на электрические и магнитные свойства вещества. Использование этой информации позволяет создавать новые материалы с заданными свойствами, такие как проводимость электричества, магнитная восприимчивость и другие.
Кроме того, определение непарных электронов может быть востребовано в биологии и медицине. Некоторые биологически активные вещества и лекарственные препараты взаимодействуют с определенными атомами на уровне непарных электронов. Изучение количества непарных электронов позволяет усовершенствовать молекулярный дизайн и создавать более эффективные и безопасные лекарственные средства.
Таким образом, определение количества непарных электронов у атома имеет широкий спектр практического применения в различных научных и технических областях. Это является важным инструментом для разработки новых материалов, изучения химических процессов и разработки лекарственных препаратов. Знание количества непарных электронов у атома позволяет прогнозировать и контролировать его свойства и взаимодействия, что способствует развитию науки и технологий.