Масса газа является одной из основных характеристик, определяющих его поведение и свойства в физике МКТ (молекулярно-кинетическая теория). Понимание и определение массы газа является важным компонентом для изучения его движения и взаимодействия с окружающей средой.
Основным принципом определения массы газа является использование идеального газа в качестве модели. Идеальный газ - это модель, в которой предполагается, что газ состоит из отдельных молекул, которые движутся в случайном направлении и не взаимодействуют друг с другом или с стенками сосуда.
Средняя кинетическая энергия молекул газа напрямую связана с его температурой и массой. В физике МКТ существуют различные методы для определения массы газа. Один из них основан на использовании закона Бойля-Мариотта, который устанавливает прямую пропорциональность между объемом газа и давлением, при постоянной температуре и количестве вещества. Определяя изменение объема газа при изменении давления, можно вычислить его массу.
Принципы определения массы газа
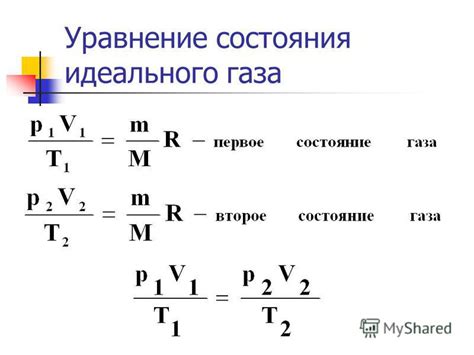
Определение массы газа основано на нескольких принципах и методах, которые позволяют точно измерить эту величину. Рассмотрим основные из них:
1. Использование идеального газа
Для удобства расчетов и измерений в физике используется модель идеального газа. Она предполагает, что газ состоит из отдельных молекул, которые не взаимодействуют друг с другом, и учитывает только их статистическое поведение. Масса идеального газа определяется с помощью уравнения состояния идеального газа, которое связывает давление, объем и температуру газа.
2. Закон Бойля-Мариотта
Закон Бойля-Мариотта устанавливает прямую пропорциональность между давлением и объемом газа при постоянной температуре. Для определения массы газа можно использовать этот закон в сочетании с измерением давления и объема газа.
3. Закон Гей-Люссака
Закон Гей-Люссака показывает, что при постоянном объеме газа его давление прямо пропорционально температуре. Используя это соотношение и измеряя давление и температуру газа, можно определить его массу.
4. Использование уравнения состояния газа
Уравнение состояния газа, также известное как уравнение Клапейрона, позволяет связать давление, объем, температуру и количество вещества газа. Используя это уравнение и измеряя три известных величины, можно определить массу газа.
| Принцип/Метод | Уравнение |
|---|---|
| Закон Бойля-Мариотта | P1V1 = P2V2 |
| Закон Гей-Люссака | P1/T1 = P2/T2 |
| Уравнение Клапейрона | PV = nRT |
Таким образом, применение указанных принципов и методов позволяет определить массу газа с высокой точностью. Они являются основой для многих физических и химических расчетов, а также используются в различных областях науки и техники.
Методы измерения массы газа

Один из наиболее распространенных методов - взвешивание газа на аналитических весах. Для этого газ помещается в специальный сосуд, который будет размещен на аналитических весах. Затем, путем сравнения веса сосуда с газом и без газа, можно определить массу газа.
Кроме взвешивания, существуют и другие методы определения массы газа. Один из таких методов - использование уравнения состояния идеального газа. При известных параметрах газа, таких как давление, температура и объем, можно рассчитать его массу с помощью соответствующих формул.
Для более точного измерения массы газа используются и специальные приборы, такие как газовые хроматографы. Они позволяют анализировать состав газовой смеси и определять массовые доли компонентов. После этого можно рассчитать массу каждого компонента, а также общую массу газа.
| Метод | Принцип | Приборы и оборудование |
|---|---|---|
| Взвешивание | Сравнение веса сосуда с газом и без газа | Аналитические весы |
| Использование уравнения состояния идеального газа | Расчет массы на основе давления, температуры и объема | Нет |
| Газовые хроматографы | Анализ состава газовой смеси для определения массовых долей компонентов | Газовый хроматограф |
Методы измерения массы газа имеют различные преимущества и ограничения. Выбор метода зависит от целей и условий эксперимента. Важно учитывать точность и надежность каждого метода при выборе способа определения массы газа.
Методы расчета массы газа

| Метод | Описание |
|---|---|
| Метод идеального газа | Основывается на использовании уравнения состояния идеального газа (PV = nRT), где P - давление, V - объем, n - количество вещества, R - универсальная газовая постоянная, T - температура. Путем измерения давления, объема и температуры газа, можно рассчитать его массу. |
| Метод статического давления | Используется для газов, у которых давление можно измерить непосредственно. С помощью манометра измеряется давление газа, затем с помощью уравнения состояния рассчитывается масса газа. |
| Метод динамического давления | Применяется для газов, у которых давление нельзя измерить напрямую. Используя роторный мерный элемент или вихревой датчик, можно измерить параметры потока газа, такие как скорость и плотность. Зная эти параметры и геометрию системы, можно рассчитать массу газа. |
| Метод гравиметрии | Основывается на измерении изменения массы системы до и после удаления или добавления газа. Разница в массе может быть использована для определения массы газа. |
Выбор конкретного метода расчета массы газа зависит от условий и параметров системы, а также от доступных средств и оборудования.
Зависимость массы газа от температуры и давления
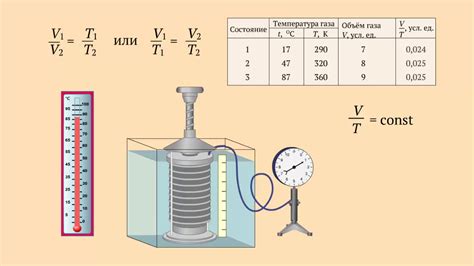
В соответствии с уравнением состояния идеального газа, масса газа прямо пропорциональна его плотности. Плотность газа, в свою очередь, зависит от его температуры и давления. При постоянном давлении, увеличение температуры приводит к увеличению массы газа, так как при нагревании молекулы газа движутся быстрее, что приводит к увеличению числа молекул в единице объема.
С другой стороны, при постоянной температуре, увеличение давления также приводит к увеличению массы газа. Это объясняется тем, что увеличение давления приводит к сжатию газа, что увеличивает его плотность и, следовательно, массу в единице объема.
Таким образом, масса газа не является постоянной величиной и зависит от значения температуры и давления. Знание зависимости массы газа от этих параметров позволяет более точно описывать и предсказывать его поведение в различных условиях.
Изотермический процесс определения массы газа

Для проведения изотермического процесса необходимо настроить экспериментальную установку, состоящую из газового сосуда, манометра и регулятора давления. Газовый сосуд должен быть полностью изолирован от окружающей среды, чтобы предотвратить изменение температуры. В процессе определения массы газа используется уравнение состояния идеального газа: PV = nRT, где P - давление газа, V - объем газа, n - количество вещества газа, R - универсальная газовая постоянная, T - температура газа.
| Шаг | Описание |
|---|---|
| 1 | Заполните газовый сосуд изучаемым газом до необходимого уровня. |
| 2 | Запишите начальное давление и объем газа. |
| 3 | Используя регулятор давления, измените давление газа в сосуде и запишите новые значения давления и объема. |
| 4 | Повторите шаг 3 несколько раз, изменяя давление газа и записывая соответствующие значения давления и объема. |
| 5 | Используя уравнение состояния идеального газа, рассчитайте количество вещества газа и его массу. |
Изотермический процесс позволяет определить массу газа, используя зависимость давления от объема при постоянной температуре. Используя уравнение состояния идеального газа и измеренные значения давления и объема, можно рассчитать количество вещества газа и его массу. Такой подход широко применяется в физике и химии для определения основных характеристик газовых смесей и прочих веществ.
Адиабатический процесс определения массы газа
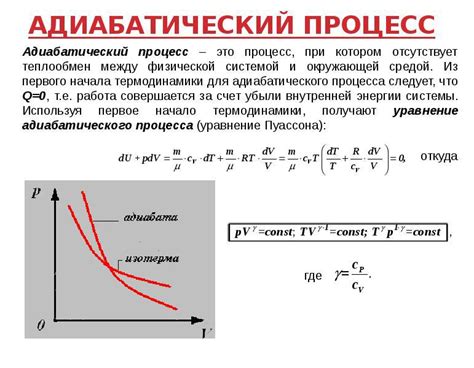
Один из таких методов - измерение давления и объема газа. Из уравнения состояния идеального газа можно получить зависимость между давлением, объемом и массой газа:
PV1n=PV2n=mRT
где P - давление газа, V - объем газа, 1 и 2 - начальные и конечные состояния газа, n - показатель адиабаты, m - масса газа, R - универсальная газовая постоянная, T - температура газа.
Для определения массы газа в адиабатическом процессе можно измерить начальное и конечное давление и объем газа, а также знать показатель адиабаты и универсальную газовую постоянную. Подставив эти значения в уравнение, можно выразить массу газа.
Однако при проведении такого опыта необходимо учитывать условия, при которых происходит процесс, такие как изотермический или адиабатический, наличие искривления в уравнении состояния газа и другие факторы, которые могут повлиять на точность определения массы газа.
Практическое применение определения массы газа
Определение массы газа имеет важное практическое значение в различных областях науки и техники.
В аэродинамике и авиационной промышленности знание массы газа позволяет оптимизировать дизайн и производство авиационных двигателей, а также улучшить эффективность работы самолетов. Знание массы газа используется при разработке новых моделей ракетных двигателей, что в свою очередь способствует улучшению космических полетов и исследованию космоса.
В химии и фармацевтической индустрии определение массы газа помогает в разработке и производстве новых химических веществ, а также в контроле качества и безопасности процессов производства. Определение массы газа используется при анализе состава воздуха, позволяющем выявить и изучить различные загрязнения и их влияние на окружающую среду.
В геологии и геофизике определение массы газа необходимо для изучения подземных газонефтяных месторождений и оценки их ресурсного потенциала. Понимание массы газа помогает в оптимизации добычи и использования природных ресурсов.
Кроме того, знание массы газа широко применяется в климатологии и метеорологии для изучения изменений в составе атмосферы, анализа погодных условий и прогнозирования климатических изменений.
Таким образом, определение массы газа играет ключевую роль в различных отраслях науки и техники, способствуя развитию инновационных технологий и решению актуальных проблем нашего мира.