Щелочи – это важные вещества в химии, которые обладают определенными свойствами и играют важную роль во многих процессах. Они являются основаниями, способными нейтрализовывать кислоты, и образуют с ними соли. Щелочные растворы часто используются в промышленности и лабораторных исследованиях.
Определение щелочи в химии может быть выполнено различными методами. Один из наиболее распространенных методов - использование определяющих признаков. Признаки щелочей могут включать такие свойства, как горчащий вкус, ощутимость на коже и отталкивание кислот.
Еще один метод определения щелочей - использование pH-индикаторов. pH-индикаторы - это вещества, которые меняют цвет в зависимости от кислотности или щелочности раствора. Они являются важными инструментами для оперативного и точного определения щелочей.
Определение щелочи в химии является важным аспектом для понимания многих химических процессов. Зная методы и признаки определения щелочей, химики могут успешно исследовать и использовать эти вещества в различных областях науки и промышленности.
Что такое щелочь в химии?

Основные признаки щелочных соединений:
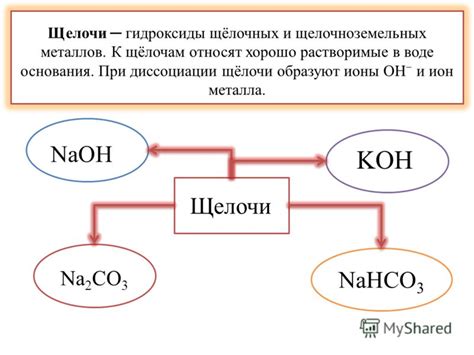
1. Основные растворимые соединения. Щелочные соединения образуют растворы, которые обладают щелочной реакцией и растворяются в воде, образуя гидроксиды. Примерами щелочей являются натрий, калий, гидроксиды кальция, магния и других металлов.
2. Гидроксиды. Гидроксиды щелочных металлов являются типичными представителями щелочей. Они обладают щелочной реакцией и широко используются в различных отраслях промышленности и научных исследованиях.
3. Щелочная реакция. Щелочные соединения обладают щелочной реакцией, то есть они образуют растворы с высоким содержанием гидроксидных ионов (OH-), которые отдают свободные электроны, придая раствору щелочные свойства.
4. Замещение водорода. Щелочные металлы замещают водород из различных соединений, образуя щелочные растворы. Например, реакция натрия с водой приводит к образованию гидроксида натрия (NaOH) и выделению водорода.
5. Универсальный индикатор. Щелочные растворы показывают щелочную реакцию при использовании универсального индикатора, который меняет цвет в зависимости от кислотности или щелочности раствора. Щелочные растворы обычно дают синий или фиолетовый цвет.
Знание и определение щелочей в химии важно для понимания различных химических и физических свойств веществ. Щелочи широко используются в промышленности и в бытовых условиях.
Определение щелочи

- Щелочи растворяются в воде, образуя щелочные растворы.
- Щелочные растворы обладают щелочной реакцией, то есть они избыточно содержат гидроксиды.
- К щелочам относятся такие вещества, как гидроксиды щелочных металлов (например, гидроксид натрия или гидроксид калия) и некоторые водные растворы щелочных оксидов.
- Щелочи имеют характерную щелочную вкусовую реакцию, вызывающую ощущение щелочности при контакте с языком.
Щелочи являются противоположностью кислот и, в сочетании с ними, образуют соли. Различные методы могут использоваться для определения щелочей:
- Кислотно-основное титрование, при котором используется реакция щелочи с кислотой.
- Использование индикаторов для определения pH растворов.
- Формирование осадка при взаимодействии щелочи с определенными соединениями.
- Измерение электропроводности растворов, так как щелочные растворы обладают высокой электропроводностью.
Определение щелочных свойств важно для понимания и оценки химических процессов, а также применяется в различных областях, включая аналитическую химию, медицину и промышленность.
Физические свойства щелочей

Растворимость – одно из важных физических свойств щелочей. Большинство щелочей хорошо растворяются в воде, образуя гидроксиды. Это позволяет использовать щелочные растворы в различных областях, таких как промышленность и бытовая химия.
Электропроводность – еще одно характерное физическое свойство щелочей. Щелочные растворы обладают способностью проводить электрический ток, так как щелочи диссоциируют в ионы гидроксида (OH-) в водном растворе. Это делает щелочи полезными в различных электрохимических процессах.
Кроме того, щелочи обладают высокой щелочностью и могут вызывать раздражение кожи и слизистых оболочек. Это особенно важно учитывать при работе с щелочами в лаборатории или в производстве.
Химические свойства щелочей

1. Реакция с кислотами: Щелочи реагируют с кислотами, образуя соли и воду. Это называется нейтрализационной реакцией. Примером такой реакции может служить реакция гидроксида натрия (NaOH) с соляной кислотой (HCl) с образованием хлорида натрия (NaCl) и воды (H2O).
2. Гидролиз: Щелочи могут гидролизироваться в водном растворе, разлагаясь на гидроксиды и ионы гидроксония (H3O+). Например, гидролиз гидроксида натрия (NaOH) приводит к образованию гидроксида алюминия (Al(OH)3) и гидроксония.
3. Окислительные свойства: Некоторые щелочи обладают окислительными свойствами и могут окислять вещества, например, гидроксид калия (KOH). Такие реакции могут иметь важное применение в химической промышленности.
4. Образование осадков: Щелочи могут образовывать осадки с определенными ионами. Например, гидроксид кальция (Ca(OH)2) образует осадок с ионами карбоната (CO32-) и ионами фосфата (PO43-).
5. Нейтрализация: Щелочи способны нейтрализовывать кислоты, образуя соли. Процесс нейтрализации может быть использован в лечебной практике для устранения избытка кислоты в организме.
Химические свойства щелочей зависят от их состава и концентрации, и их изучение имеет важное значение в различных областях науки и промышленности.
Методы определения щелочей

Одним из самых распространенных методов определения щелочей является кислотно-основной титрование. Этот метод основан на реакции щелочи с кислотой в присутствии индикатора, который меняет цвет в зависимости от превышения концентрации основания или кислоты. Результаты титрования используются для определения концентрации щелочи.
Другой метод определения щелочей – гравиметрический анализ. Этот метод основан на осаждении и взвешивании основания из раствора. Процесс осаждения может быть стимулирован химической реакцией или физическим воздействием, например, нагреванием. Взвешивание основания позволяет определить его концентрацию в исходном растворе.
Для определения щелочей также используются инструментальные методы. К ним относятся электрохимические методы, такие как потенциометрия и вольтамперометрия, которые основаны на измерении электрических свойств раствора щелочи. Спектроскопические методы, такие как ИК-спектроскопия и УФ-видимая спектроскопия, позволяют определить химический состав и концентрацию оснований.
Также существуют методы определения щелочей, основанные на их физических свойствах. Например, измерение pH раствора может использоваться для определения концентрации щелочи, поскольку она обладает основной активностью и повышает значение pH. Калориметрия – метод, основанный на измерении теплового эффекта при реакции щелочи с кислотой или другим веществом.
| Метод | Принцип | Преимущества | Недостатки |
|---|---|---|---|
| Кислотно-основное титрование | Измерение количества кислоты или основания, необходимого для нейтрализации | Простота, широкое применение | Требует использования индикатора, может быть ограничен точностью |
| Гравиметрический анализ | Взвешивание осадка основания для определения его концентрации | Высокая точность, независимость от индикаторов | Требует времени и сложных операций, может быть ограничен применимостью к определенным щелочам |
| Электрохимические методы | Измерение электрических свойств раствора щелочи | Высокая точность, широкий диапазон применимости | Требуют специального оборудования и знаний |
| Спектроскопические методы | Анализ светового спектра раствора щелочи | Высокая чувствительность, возможность определения состава и концентрации | Требуют дорогостоящего оборудования и специальных навыков |
| Измерение pH | Определение кислотности или щелочности раствора | Простота, доступность | Низкая точность, возможны систематические ошибки |
| Калориметрия | Измерение теплового эффекта при реакции щелочи | Прямое измерение химической реакции | Ограничен применимостью к определенным реакциям и щелочам |
Признаки щелочей

Щелочи, или основания, обладают определенными характеристиками, которые позволяют идентифицировать их и отличать от других соединений. Вот некоторые признаки щелочей:
- Горечь: Щелочные соединения обычно имеют горький вкус. Это один из самых распространенных признаков, которые помогают отличить щелочные растворы от кислотных.
- Красители: Щелочные растворы часто реагируют с красителями, изменяя их цвет. Например, красный капельник, погруженный в щелочной раствор, может стать зеленым.
- Темно-синяя фенольфталеиновая окраска: Щелочные растворы, содержащие щелочь, обычно обладают темно-синей окраской при добавлении фенольфталеина. Этот признак может быть использован для определения наличия щелочи в растворе.
- Реакция с кислотами: Щелочи обладают свойством нейтрализовать кислоты. Если щелочь добавляется к кислотному раствору, образуется реакция нейтрализации, сопровождающаяся выделением тепла и изменением pH.
- Образование осадка: Щелочи могут образовывать осадок при реакции с некоторыми соединениями. Например, реакция щелочи с хлоридом свинца приводит к образованию белого осадка хлорида свинца.
Это лишь некоторые из признаков, которые позволяют идентифицировать щелочи в химических реакциях. Использование нескольких признаков вместе обеспечивает более надежный способ определения наличия щелочи и различения ее от других соединений.
Применение щелочей в химии
- Производство мыла и моющих средств: Щелочи, такие как гидроксид натрия (NaOH) и гидроксид калия (KOH), используются в производстве мыла и моющих средств. Они реагируют с жирами и маслами, превращая их в мыло.
- Очистка и обезжиривание: Щелочи используются для очистки и обезжиривания поверхностей, таких как металлы и стекло. Они растворяют загрязнения и удаляют жиры и масла.
- Производство стекла: Некоторые щелочи, такие как гидроксид натрия и гидроксид калия, используются в производстве стекла. Они понижают температуру плавления и повышают прозрачность стекла.
- Производство удобрений: Щелочи, такие как гидроксид калия, используются в производстве удобрений. Они содержат калий, который является одним из основных питательных веществ для растений.
- Регулирование pH: Щелочи используются для регулирования pH-уровня в различных химических процессах, таких как производство бумаги и текстиля, а также в водоочистке и обработке сточных вод.
- Аналитическая химия: Щелочи используются в аналитической химии для установления точки эквивалентности в титровании и для регулирования pH-уровня в реакциях анализа различных веществ.
Применение щелочей в химии очень разнообразно и значительно влияет на нашу повседневную жизнь. Они являются неотъемлемой частью многих процессов и продуктов, которые мы используем и потребляем ежедневно.
Преимущества и недостатки использования щелочей

Преимущества:
- Эффективность очистки: щелочные вещества обладают мощными очищающими свойствами и успешно справляются с удалением различных загрязнений, включая жиры, масла и органические вещества.
- Универсальность: щелочи могут использоваться для очистки различных поверхностей, включая металлы, стекло, керамические изделия и текстиль.
- Низкая стоимость: многие щелочные вещества доступны по низким ценам и широко применяются в различных отраслях, включая промышленность, бытовую химию и медицину.
- Химическая реакция: при взаимодействии щелочей с кислотами возникают реакции нейтрализации, которые широко используются в различных процессах.
Недостатки:
- Опасность при неправильном использовании: щелочные вещества могут быть опасными при контакте с кожей, глазами или вдыхании. Необходимо соблюдать меры предосторожности при работе с ними.
- Разрушение материалов: некоторые материалы, такие как алюминий, медь и некоторые пластмассы, могут быть повреждены или разрушены под воздействием щелочей.
- Окружающая среда: неконтролируемое или неправильное использование щелочей может привести к загрязнению окружающей среды и негативному влиянию на экосистему.
В целом, использование щелочей имеет свои преимущества и недостатки. Правильное применение и соблюдение мер безопасности позволяют получить высокую эффективность очистки и достичь желаемых результатов.