Орбитальное квантовое число – это одно из ключевых понятий в квантовой механике, которое используется для описания электронных орбиталей атома. Для начинающих, понимание этого числа может оказаться сложным заданием, но имея некоторые базовые знания, вы сможете разобраться с ним легко.
Орбитальное квантовое число определяет энергетический уровень электрона и его форму или орбиталь, на которой он может находиться в атоме. Оно обозначается символом "n" и может принимать только целочисленные значения, начиная от 1. Чем больше значение орбитального квантового числа, тем выше энергетический уровень электрона и тем дальше он находится от ядра атома.
Орбитальное квантовое число также определяет количество подуровней энергии, которые могут существовать на данном энергетическом уровне. Количество подуровней равно квадрату орбитального квантового числа (n^2), то есть для первого уровня (n=1) существует только один подуровень, для второго (n=2) – уже четыре подуровня и так далее.
Для того чтобы в полной мере понять значение орбитального квантового числа, необходимо продолжить изучение других квантовых чисел электрона, таких как азимутальное квантовое число, магнитное квантовое число и спиновое квантовое число. Вместе эти числа определяют полное описание состояния электрона.
Орбитальное квантовое число электрона: основы и принципы

Орбитальное квантовое число имеет принципиальное значение для понимания строения электронных оболочек атома. Каждый энергетический уровень может содержать одну или несколько подорбиталей, с определенными формой и ориентацией в пространстве. Число подорбиталей на каждом энергетическом уровне равно квадрату значения орбитального квантового числа.
| Орбитальное квантовое число (n) | Число подорбиталей на уровне | Максимальное число электронов на уровне |
|---|---|---|
| 1 | 1 | 2 |
| 2 | 4 | 8 |
| 3 | 9 | 18 |
Таким образом, для каждого энергетического уровня определено максимальное число электронов, которые могут находиться на нем. Например, на первом энергетическом уровне может находиться максимум 2 электрона, на втором – 8 электронов, а на третьем – 18 электронов.
Орбитальное квантовое число также влияет на энергию электронных орбиталей и стабильность атома. Чем выше значение n, тем более высокий энергетический уровень занимают электроны, и тем более нестабилен атом. Это объясняется тем, что электроны с большим орбитальным квантовым числом находятся на более удаленных от ядра орбиталях, что делает их менее устойчивыми.
Что такое орбитальное квантовое число электрона?

В области атомной физики электроны в атомах движутся по определенным энергетическим уровням, называемым "оболочками". Каждая оболочка делится на подобласти, называемые "орбиталями". Орбитальное квантовое число определяет форму орбитали и может принимать целочисленные значения от 0 до (n-1), где n - главное квантовое число, определяющее энергетический уровень оболочки.
| Орбиталь | Обозначение | Форма | Максимальное число электронов |
|---|---|---|---|
| с | s | сферическая | 2 |
| p | p | двуполостная | 6 |
| d | d | четырехполостная | 10 |
| f | f | сложная форма | 14 |
Орбитальное квантовое число определяет также энергию орбитали. Чем больше значение этого числа, тем выше энергетический уровень орбитали и электрона, находящегося на ней. Например, орбиталь с обозначением s имеет наименьшую энергию, орбиталь с обозначением p - следующую по величине и т.д.
Орбитальное квантовое число электрона играет важную роль в понимании строения атомов и молекул, а также в объяснении и предсказании химической активности элементов и их соединений.
Значение орбитального квантового числа в атомной физике
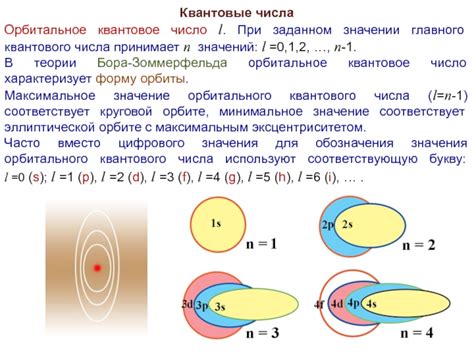
Орбитальное квантовое число имеет целочисленное значение от 0 до (n-1), где n - главное квантовое число, определяющее энергетический уровень электрона в атоме. Таким образом, для каждого значения n существует n различных значений орбитального квантового числа.
Значение орбитального квантового числа также определяет орбиталь, на которой находится электрон. Например, для орбиталей с n=1 значение орбитального квантового числа равно 0, что соответствует орбитали s. Для орбиталей с n=2 значение орбитального квантового числа может быть 0 или 1, что соответствует орбиталям s и p соответственно. Для орбиталей с n=3 значение орбитального квантового числа может быть 0, 1 или 2, что соответствует орбиталям s, p и d соответственно, и так далее.
Орбитальное квантовое число имеет важное значение для понимания химических свойств и реакций элементов. Знание о значении орбитального квантового числа позволяет предсказывать спин и магнитные свойства электронов, а также их поведение в электромагнитных полях.
Как определить орбитальное квантовое число?

Существует несколько способов определения орбитального квантового числа.
1. Найти главное квантовое число (n), которое определяет энергетический уровень электрона. Главное квантовое число можно найти из номера строки в периодической системе элементов.
2. Определить валентную электронную конфигурацию элемента. Это можно сделать, следуя правилам квантовой механики для заполнения энергетических уровней электронами.
3. Найти последний энергетический уровень в валентной электронной конфигурации и определить номер орбитали на этом уровне. Номер орбитали соответствует орбитальному квантовому числу.
| Орбитальное квантовое число (l) | Форма орбитали |
|---|---|
| 0 | s |
| 1 | p |
| 2 | d |
| 3 | f |
Таким образом, зная последний энергетический уровень и форму орбитали, можно определить орбитальное квантовое число.
Например, если последний энергетический уровень элемента имеет форму орбитали "p", то орбитальное квантовое число будет равно 1.
Орбитальное квантовое число имеет большое значение в химии и физике, так как влияет на электронную конфигурацию атома и распределение электронных облаков. Понимание этого понятия позволяет лучше понять строение и свойства атомов.
Энергетические уровни и орбитальные квантовые числа
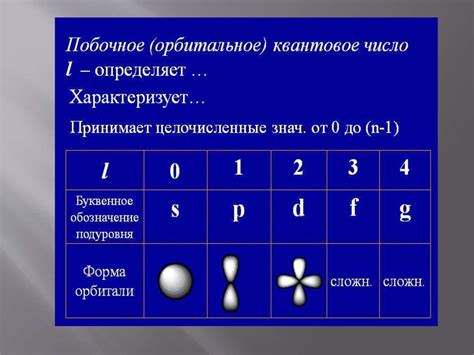
Орбитальное квантовое число электрона определяет энергетический уровень, на котором находится данный электрон. В атоме каждый электрон может находиться только на одном из этих энергетических уровней, и его орбитальное квантовое число помогает определить, на каком конкретно уровне он находится.
Энергетические уровни обозначаются главным квантовым числом (n) и могут принимать целочисленные значения от 1 до бесконечности. Чем больше значение главного квантового числа, тем выше энергетический уровень. Соответственно, электроны с разными значениями главного квантового числа находятся на разных уровнях энергии.
Орбитальное квантовое число (l) определяет форму орбитали, на которой находится электрон. Оно может принимать значения от 0 до (n-1). Например, для электрона на первом энергетическом уровне (n = 1) орбитальное квантовое число (l) равно 0. Для электрона на втором энергетическом уровне (n = 2) оно может быть 0 или 1, и так далее.
Из сочетания значений главного и орбитального квантовых чисел можно определить конкретную орбиталь электрона. Например, электрон находящийся на первом энергетическом уровне (n = 1) и имеющий орбитальное квантовое число (l) равное 0, находится на орбитале s. Электрон с орбитальным квантовым числом (l) равным 1 на том же энергетическом уровне находится на орбитале p, и так далее.
Таким образом, энергетические уровни и орбитальные квантовые числа электрона позволяют более точно определить его положение и свойства в атоме.
Орбитальные квантовые числа и распределение электронов в атоме
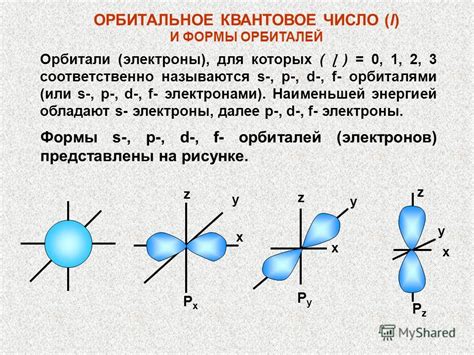
Значение орбитального квантового числа l определяет форму орбитали, на которой находится электрон. Каждой форме орбитали соответствует своя буквенная обозначение: s, p, d или f. Орбитальные формы имеют различное количество плоскостей, в которых может находиться электрон. Например, для l=0 (s-орбиталь) электрон находится в одной плоскости, для l=1 (p-орбиталь) - в трех плоскостях, для l=2 (d-орбиталь) - в пяти плоскостях и так далее.
Распределение электронов в атоме определяется принципом Паули и правилом Хунда. Принцип Паули утверждает, что в одной орбитали могут находиться не более двух электронов с противоположными спинами. Правило Хунда гласит, что при заполнении орбиталей с одинаковыми значениями n и l сначала заполняются орбитали с наименьшей энергией.
| Орбитальное квантовое число l | Форма орбитали | Количество плоскостей |
|---|---|---|
| 0 | s | 1 |
| 1 | p | 3 |
| 2 | d | 5 |
| 3 | f | 7 |
| ... | ... | ... |
Распределение электронов в орбиталях осуществляется в соответствии с правилами заполнения, указанными выше. Когда все орбитали с нижними значениями n и l заполнены электронами, начинается заполнение орбиталей с более высокими значениями n и l. Таким образом, орбитали заполняются последовательно, с учетом их энергетических уровней.
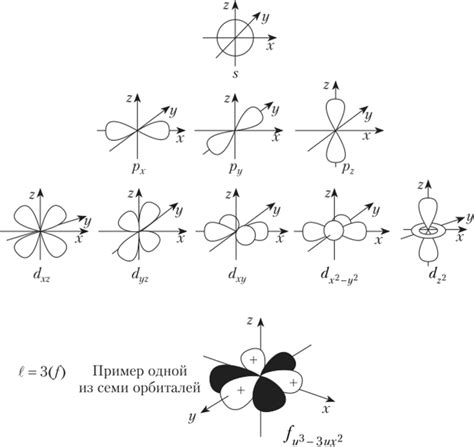
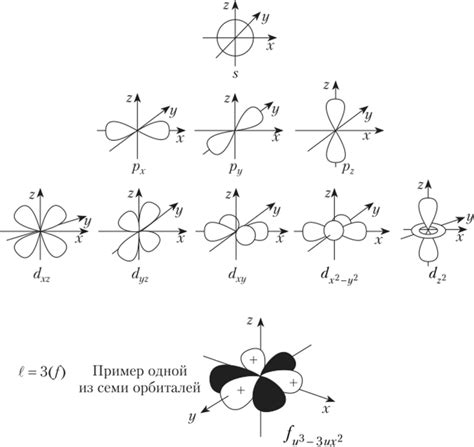
Отличия орбитальных квантовых чисел s, p, d и f
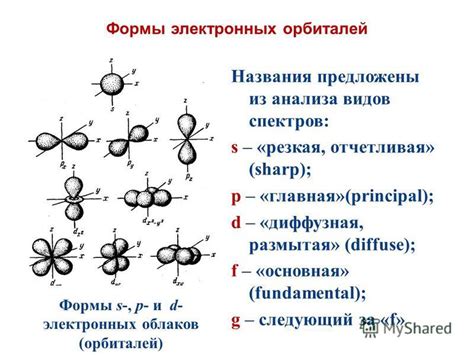
Орбитальное квантовое число электрона определяет форму орбитали и описывает ее ориентацию в пространстве. Оно обозначается буквами s, p, d и f и имеет важные отличия.
- Орбитальное квантовое число s: это основное орбитальное квантовое число, которое имеет значение 0. Оно описывает орбитали сферической формы и является самой близкой орбиталью к ядру атома.
- Орбитальное квантовое число p: это следующее после s орбитальное квантовое число и имеет значение 1. Оно описывает орбитали формы показинчиков и состоит из трех подорбиталей.
- Орбитальное квантовое число d: это орбитальное квантовое число, которое имеет значение 2. Оно описывает орбитали сложной формы с двумя плоскостями узлов, и состоит из пяти подорбиталей.
- Орбитальное квантовое число f: это самое высокое орбитальное квантовое число и имеет значение 3. Оно описывает орбитали очень сложной формы с тремя плоскостями узлов и состоит из семи подорбиталей.
Понимание различий между орбитальными квантовыми числами помогает в анализе электронной структуры атомов и молекул, а также в предсказании и объяснении их свойств и реакций.
Подробнее о первом орбитальном квантовом числе (n)

В квантовой механике орбитальное квантовое число (n) определяет основной энергетический уровень электрона в атоме. Число (n) может принимать целочисленные значения, начиная от 1 и увеличиваясь на единицу. Каждому уровню соответствует определенная энергия.
Первый орбитальный уровень (n = 1) называется K-оболочкой и имеет наименьшую энергию. В рамках данного уровня находится только одна орбиталь, называемая 1s-орбиталью. На этой орбитали может находиться максимум 2 электрона. Они могут иметь противоположные значения спина (вверх и вниз).
Изначально, когда атом находится в основном состоянии, все электроны заполняют наиболее низкие энергетические уровни, поэтому первая орбитальная оболочка (K-оболочка) всегда будет заполнена первой. После этого электроны могут начинать занимать более высокие орбитали.
Орбитальное квантовое число (n) является важным параметром, определяющим расположение электрона в атоме и его энергию. Зная значение (n), можно рассчитать радиус орбиты электрона, а также предсказать другие свойства и поведение атома.
Влияние орбитального квантового числа на химические свойства
Орбитальное квантовое число принимает целочисленные значения от 0 до n-1, где n - главное квантовое число. Большее значение орбитального квантового числа соответствует орбиталям большего размера и более высокой энергии. Например, для первого энергетического уровня (n=1) орбитальное квантовое число может быть только равно 0, что соответствует s-орбитали. На втором уровне (n=2) орбитальное квантовое число может быть равно 0 или 1, что соответствует s- и p-орбиталям соответственно.
Размер и форма орбитали влияют на вероятность нахождения электрона в определенной области пространства. Соответственно, химические свойства элемента зависят от количества электронов в каждой орбитали. Например, если на внешней s-орбитали есть один электрон, элемент принадлежит к группе щелочных металлов. Если внешняя p-орбиталь заполнена одним или двумя электронами, элемент принадлежит к группе галогенов или категории инертных газов соответственно.
Кроме того, орбитальное квантовое число также влияет на взаимодействие электронов между собой. Например, если два электрона занимают одну орбиталь, они должны иметь противоположные спины (спиновые квантовые числа). Это условие обусловлено принципом запрещенного состояния Паули, который гласит, что два электрона не могут находиться в одном квантовом состоянии с одинаковыми спинами.
| Орбитальное квантовое число (l) | Форма орбитали | Пример |
|---|---|---|
| 0 | s | 1s2 |
| 1 | p | 2p6 |
| 2 | d | 3d10 |
| 3 | f | 4f14 |
Орбитальные квантовые числа в молекулярной физике
Существует три орбитальных квантовых числа: главное квантовое число (n), орбитальное квантовое число (l) и магнитное квантовое число (m). Каждое из них характеризует определенные аспекты энергетического уровня и межатомных взаимодействий.
Главное квантовое число (n) определяет энергетический уровень, на котором находится электрон. Чем больше значение n, тем выше энергетический уровень. Например, если n=1, электрон находится на первом энергетическом уровне, называемом K-оболочкой. Если n=2, электрон находится на втором энергетическом уровне, называемом L-оболочкой, и так далее.
Орбитальное квантовое число (l) определяет форму орбитали, на которой находится электрон. Оно принимает целочисленные значения от 0 до n-1. Например, если n=2, то l может быть равно только 0 или 1. Когда l=0, орбиталь имеет форму s-орбитали, когда l=1 - форму p-орбитали и так далее. Форма орбитали влияет на симметрию электронной оболочки и, следовательно, на свойства молекулы.
Магнитное квантовое число (m) определяет ориентацию орбитали в пространстве. Оно принимает значения от -l до l, включая ноль. Например, если l=1, то m может принимать значения -1, 0 и 1. Эти значения характеризуют орбитали p-подуровней, которые имеют форму трехизмерных фигур - шарового, двух- и одноосных.
Орбитальные квантовые числа помогают описать энергетическое состояние электрона в атоме или молекуле, а также его форму и ориентацию в пространстве. Это важная информация для понимания связей между атомами и свойств молекул, что делает орбитальные квантовые числа важными в молекулярной физике.
Как использовать орбитальные квантовые числа в химических расчетах
- Основное квантовое число (n) определяет энергетический уровень электрона и может принимать значения от 1 до бесконечности.
- Орбитальное квантовое число (l) определяет форму орбитали и может принимать значения от 0 до (n-1).
- Магнитное квантовое число (m) определяет ориентацию орбитали в пространстве и может принимать значения от -l до l.
В химических расчетах орбитальные квантовые числа используются для отображения распределения электронов в атомах и молекулах.
Одним из основных применений орбитальных квантовых чисел является определение электронной конфигурации атомов. Электронная конфигурация представляет собой распределение электронов по энергетическим уровням и подуровням. Основное квантовое число (n) определяет энергетические уровни, орбитальное квантовое число (l) определяет подуровни, а магнитное квантовое число (m) определяет число орбиталей на каждом подуровне.
Кроме того, орбитальные квантовые числа используются для определения спина электрона. Спин электрона может иметь только два значения: "вверх" или "вниз", обозначаемые символами ↑ и ↓. Спин электрона влияет на магнитный момент атома или молекулы, что имеет прямое отношение к его химическим свойствам.