Осадка, возникающая при добавлении сульфида натрия к раствору нитрата хрома 3, является результатом химической реакции между этими соединениями. Синтез сульфида хрома, в свою очередь, основан на реакции диспропорционирования сульфита хрома 3.
Сульфит хрома 3, который является белорозовым кристаллическим веществом, в растворе нитрата хрома 3 окисляется до сульфата хрома 3. При этом одна часть соединения окисляется, образуя сульфат хрома 3, а другая - восстанавливается до сульфида хрома, который образует характерную осадку - темно-зеленый осадок.
Таким образом, реакция сульфида натрия с нитратом хрома 3 является примером окислительно-восстановительной реакции, при которой происходит образование осадка, связанного с образованием сульфида хрома.
Почему осаждается сульфид натрия и нитрат хрома 3
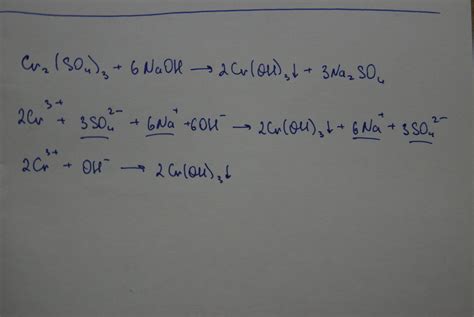
Процесс осаждения сульфида хрома 3 является реакцией двух солей: нитрата хрома 3 и сульфида натрия.
Уравнение реакции:
| Cr(NO3)3 + 3Na2S -> | Cr2S3 + 3NaNO3 |
Как видно из уравнения, при взаимодействии сульфида натрия с нитратом хрома 3 образуется осадок сульфида хрома 3 и образуются соли натрия (NaNO3).
Осадок сульфида хрома 3 образуется в результате образования нелинейных полимерных цепей, состоящих из атомов хрома и серы. Осадок имеет темно-зеленый цвет и аморфную структуру.
Таким образом, добавление сульфида натрия к раствору нитрата хрома 3 приводит к образованию осадка сульфида хрома 3, что объясняется реакцией образования соединения между сульфидом натрия и нитратом хрома 3.
Характеристики сульфида натрия

Сульфид натрия широко используется в различных областях, включая химическую промышленность, производство цветных металлов и аналитическую химию.
Ниже приведены основные характеристики сульфида натрия:
- Химическая формула: Na₂S
- Молярная масса: 78.045 г/моль
- Внешний вид: бесцветные или белые кристаллы
- Температура плавления: 1180 °C
- Температура кипения: 1680 °C
- Растворимость в воде: без распада
- pH раствора: около 12-14 (сильная щелочная среда)
Сульфид натрия обладает рядом важных химических свойств, которые делают его полезным в различных процессах и применениях. Он может использоваться как источник серы в различных химических реакциях, а также как депрессант, ингибирующий рост микроорганизмов.
Свойства нитрата хрома 3
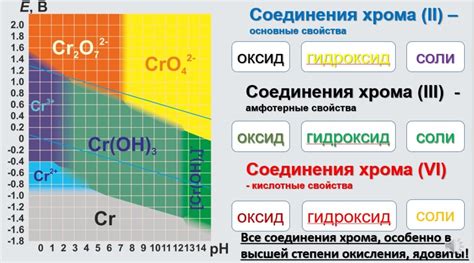
Нитрат хрома 3 (Cr(NO3)3) представляет собой неорганическое соединение, состоящее из иона хрома 3+ и нитратных ионов. Он обладает следующими свойствами:
- Нитрат хрома 3 имеет зеленый цвет и представляет собой кристаллическое вещество, растворимое в воде.
- При нагревании нитрат хрома 3 разлагается на оксид хрома 3 и диоксид азота, выделяя кислород газом.
- Образует гидратированные соли, например, шести- и девятиводный нитрат хрома 3.
- В растворе нитрат хрома 3 может образовывать комплексные ионы с различными лигандами, например, с аммиаком или этилендиамином.
- Используется в химическом анализе для обнаружения присутствия ионов хрома 3+.
Знание свойств нитрата хрома 3 позволяет более глубоко понять его химическую активность и использование в различных областях науки и промышленности.
Особенности реакции сульфида натрия с нитратом хрома 3

Осаждение сульфида хрома обусловлено образованием нерастворимого вещества - сульфида хрома. В ходе реакции ионы натрия и нитрата не реагируют, а ионы сульфида присоединяются к ионам хрома 3, образуя нерастворимое соединение.
Данная реакция особенно полезна в аналитической химии для определения наличия ионов хрома 3 в растворе. Образование осадка является положительным признаком присутствия ионов хрома 3 и может быть использовано для их качественного и количественного анализа.
Более того, реакция осаждения сульфида хрома может использоваться для разделения ионов хрома 3 от других ионов, так как многие ионы, включая катионы щелочных металлов, не образуют нерастворимых соединений с сульфидом хрома.
Осадок, образующийся в результате реакции, является темно-коричневым и обладает характерным запахом сероводорода. Для лучшего обнаружения осадка можно использовать световую подложку или микроскоп для более детального исследования.
Таким образом, реакция сульфида натрия с нитратом хрома 3 является важным инструментом в аналитической химии и имеет свои особенности, которые делают ее полезной для определения наличия ионов хрома 3 в растворе.
Образование осадка при взаимодействии реагентов
Сульфид натрия (Na2S) – это растворимая соль, представленная в виде бесцветных кристаллов. Когда сульфид натрия добавляется в раствор нитрата хрома 3 (Cr(NO3)3), происходит образование осадка.
Реакция между сульфидом натрия и нитратом хрома 3 протекает следующим образом:
- Ионы сульфида натрия (Na2S) и ионы нитрата хрома 3 (Cr(NO3)3) взаимодействуют между собой.
- В результате реакции образуются ионы сульфида хрома 3 (Cr2S3) и ионы нитрата натрия (NaNO3).
- Ионы сульфида хрома 3 (Cr2S3) нерастворимы в воде и выпадают в виде мелких частиц, образуя осадок.
Осадок, образующийся при взаимодействии сульфида натрия и нитрата хрома 3, представляет собой темно-зеленое вещество. Он может быть отделен от раствора путем фильтрации.
Образование осадка является результатом парных ионных реакций, в которых ионы сульфида (S2-) и ионы хрома (Cr3+) взаимодействуют, образуя нерастворимые сульфиды. Эта реакция является типичным примером образования осадка при взаимодействии реагентов в растворе.
Главный компонент осадка
Реакция между ионами хрома(III) и ионами сульфида протекает в среде, где pH обычно выше 7. При нейтральной или щелочной среде образующийся осадок Cr2S3 стабилен и обладает низким растворимостью. Однако в кислой среде осадок нестабилен и может диссоциировать, что может привести к образованию растворимых комплексов хрома(III) со сульфидом.
Сульфид хрома(III) (Cr2S3) обычно образует мелкий осадок маленьких зеленоватых частиц, которые можно наблюдать в виде мутности в растворе. Этот осадок может быть отфильтрован и промыт для удаления лишнего реагента и других примесей.
Применение реакции сульфида натрия и нитрата хрома 3

Реакция сульфида натрия и нитрата хрома 3 широко применяется в химическом анализе для обнаружения и качественного определения ионов хрома Cr3+.
Эта реакция основана на образовании осадка чёрного цвета – сульфида хрома Cr2S3, который низко растворим в воде.
Применение реакции сульфида натрия и нитрата хрома 3 возможно благодаря тому, что сульфид натрия Na2S тесно взаимодействует с ионами хрома 3 Cr3+, выпадая в виде сложного вещества.
Эта реакция аналитически полезна, так как ионы хрома Cr3+ имеют ярко-красный цвет, а их образование как осадка чёрного цвета является индикатором. Прокрашивание раствора добавлением сульфида натрия позволяет легко определить наличие ионов хрома 3, а также примерное их количество.
Использование этой реакции находит применение в различных областях, включая аналитическую химию, медицину, экологию и другие. Она помогает определить содержание хрома в различных материалах и веществах, а также контролировать его уровень в окружающей среде.



