Периодическая система элементов Менделеева - это уникальная классификация химических элементов, разработанная российским ученым Дмитрием Ивановичем Менделеевым в конце XIX века. Она является основой современной химии и используется во всех областях естествознания и промышленности.
Принципы периодической системы Менделеева основаны на упорядочении элементов по атомному номеру и строении атомов. Основная идея заключается в том, что большинство химических свойств элементов периодически повторяется при изменении их атомных номеров. Это позволяет предсказывать химическую активность элементов и их реакционную способность.
Важно отметить, что периодическая система Менделеева постоянно совершенствуется. Каждый год открыются новые элементы и проводятся исследования, направленные на поиск способов использования элементов для разных целей. Периодическая система Менделеева - это не только важнейший инструмент для химиков, но и удивительное практическое проявление универсальности законов природы.
Базовые понятия и история

Первые попытки формирования периодической системы элементов были предприняты еще в древности. Однако саму таблицу Менделеева разработал в середине XIX века русский ученый Дмитрий Иванович Менделеев. Он составил таблицу, в которой элементы были расположены по порядку возрастания атомных масс, а также учитывал их химические свойства.
Важным понятием в периодической системе элементов является атомный номер элемента. Он определяется числом протонов в ядре атома и обозначается символом Z. В таблице Менделеева атомные номера элементов расположены по возрастанию слева направо и сверху вниз.
Таблица Менделеева состоит из строк, которые называются периодами, и столбцов, которые называются группами. По горизонтали элементы располагаются в порядке возрастания атомных номеров, а по вертикали элементы схожих свойств объединены в группы.
Каждый элемент в таблице Менделеева имеет свое химическое обозначение. Оно состоит из одной или двух латинских букв, которые обычно соответствуют первым буквам названия элемента.
Принципы организации периодической системы Менделеева
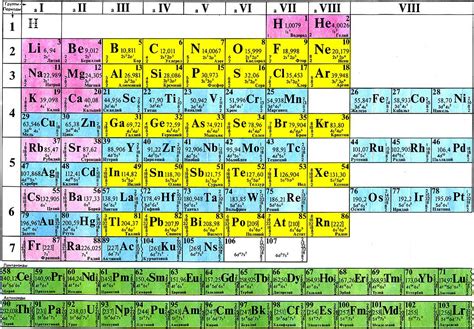
Принципы, которыми руководствовался Дмитрий Иванович Менделеев при создании системы, включают следующие:
- Организация по возрастанию атомной массы: Элементы в периодической системе располагаются в порядке возрастания атомной массы, начиная с наименьшей. Это позволяет наблюдать закономерности и связи между элементами.
- Группировка по аналогии: Элементы схожих химических свойств и реакционной способности группируются в одну вертикальную колонку, называемую группой или семейством элементов. Это упрощает понимание связей и сходств между элементами.
- Построение периодов: Элементы схожей структуры электронных оболочек располагаются в одной горизонтальной строке, называемой периодом. Каждый новый период начинается с электронной оболочки большей энергии. Это помогает выявить периодическую закономерность химических свойств.
- Расположение блоков s, p, d, f: В периодической системе элементов существуют различные блоки, которые отражают особенности электронной конфигурации элементов. Блоки s, p, d, f указывают на тип заполненности электронных оболочек и расположены горизонтально в системе.
- Прогнозирование новых элементов: Пустые клетки в системе указывают на возможное существование и свойства новых элементов, которые на момент составления системы еще не были открыты. Это позволяет предсказывать свойства и местоположение этих элементов в периодической системе.
Принципы организации периодической системы Менделеева позволяют увидеть закономерности и связи между элементами, классифицировать их и предсказывать свойства новых элементов. Это позволяет химикам и ученым более глубоко изучать и понимать мир химических элементов.
Атомы и свойства элементов
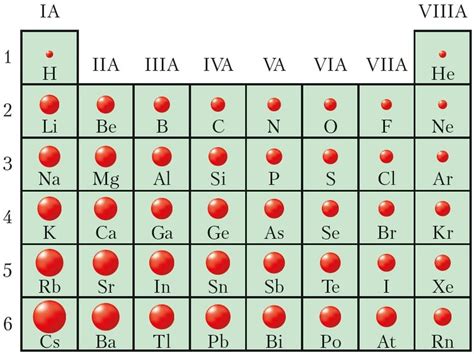
Каждый атом состоит из ядра и электронной оболочки. Ядро атома содержит протоны и нейтроны. Протоны - это положительно заряженные частицы, а нейтроны - это частицы без заряда. Количество протонов в ядре определяет атомный номер элемента.
Вокруг ядра атома находятся электроны. Электроны - это отрицательно заряженные частицы. Их количество равно количеству протонов в ядре в нейтральном атоме. Электроны находятся на разных энергетических уровнях, или оболочках. Ближе к ядру находятся энергетически более низкие оболочки, а дальше - более высокие.
Свойства элементов определяются их атомной структурой. Количество протонов в ядре определяет заряд ядра и определяет химические свойства элемента. Количество электронов определяет расположение элемента в периодической системе и определяет его физические свойства. Кроме того, атомная масса элемента включает в себя долю массы нейтронов в ядре и влияет на его физические свойства.
Таким образом, атомы и их свойства являются основой периодической системы элементов Менделеева. Изучение атомной структуры и свойств элементов позволяет понять их поведение и реакционную способность, а также предсказать новые соединения и материалы.
Основные блоки в периодической системе Менделеева

Периодическая система элементов Менделеева подразделяется на несколько основных блоков, каждый из которых имеет свои особенности и свойства. Основные блоки включают:
- Блок s - включает элементы s-блока, расположенные на левой стороне периодической системы. В этом блоке находятся щелочные металлы (лиитий, натрий, калий), щелочноземельные металлы (магний, кальций, барий), а также элементы-постоянные газы (неон, аргон и др.). Они обладают общими свойствами, такими как низкая электроотрицательность и высокая реакционная способность.
- Блок p - расположен над s-блоком и включает элементы p-блока. В этом блоке находятся несколько групп элементов, включая дуговую группу (кислород, сера, селен), галогены (фтор, хлор, бром) и инертные газы (гелий, неон, аргон). Элементы p-блока обладают различными химическими свойствами и широко используются в различных отраслях науки и промышленности.
- Блок d - находится в центральной части периодической системы и включает элементы d-блока. В этом блоке находятся переходные металлы (железо, золото, медь), а также лантаноиды и актиноиды. Элементы d-блока обладают характерными свойствами, такими как высокая термостабильность и способность образования соединений с различными степенями окисления.
- Блок f - находится под d-блоком и включает элементы f-блока. В этом блоке находятся лантаноиды (лантан, церий, прасеодим) и актиноиды (актиний, торий, уран). Элементы f-блока обладают особыми физическими и химическими свойствами и широко используются в ядерной энергетике и многих других областях науки.
Каждый блок элементов в периодической системе Менделеева имеет свою собственную важность и уникальные характеристики, которые определяют их роль в химии и других научных областях.
Блоки s, p, d и f

В периодической системе элементов Менделеева существуют четыре основных блока: s, p, d и f. У каждого блока есть свои особенности и характеристики.
Блок s состоит из двух групп элементов - группы 1 и 2. Эти элементы обладают общими свойствами: они являются металлами и обладают высокой электропроводностью. Они имеют один с наименьшим уровнем энергии.
Блок p состоит из трех групп элементов - группы 13-18. Эти элементы также обладают общими свойствами: ионизационная энергия увеличивается с возрастанием атомного номера, они обладают высокой электронной отрицательностью. В блоке p находятся металлы, полуметаллы и неметаллы.
Блок d состоит из переходных элементов. Эти элементы обладают большей вариативностью химических свойств и образуют множество соединений. Они являются металлами средней активности и обладают способностью образовывать ионы с различными зарядами.
Блок f состоит из лантаноидов и актиноидов. Эти элементы являются металлами активной активности и обладают большим количеством электронных оболочек. Они имеют особые свойства и используются в различных отраслях науки и техники.
Химические свойства элементов в периодической системе Менделеева
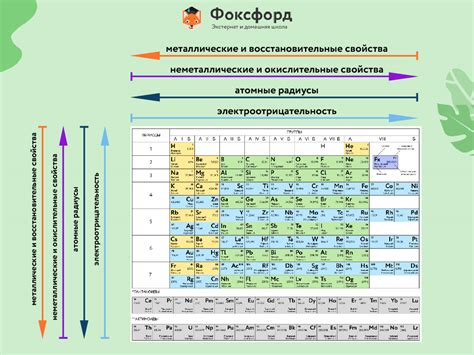
Одной из ключевых особенностей периодической системы Менделеева является ее структура, основанная на атомной структуре элементов. Элементы упорядочены по порядковым номерам (от наименьшего к наибольшему) и разделены на периоды и группы. Периоды представляют собой строки элементов, а группы – столбцы элементов.
Химические свойства элементов в периодической системе указывают на их способность вступать в химические реакции с другими элементами. Они определяют, как элементы могут образовывать соединения и взаимодействовать с другими веществами.
Различные химические свойства элементов включают в себя их валентность, реактивность, способность образовывать кислоты и основания, окислительность и многое другое. Свойства элементов могут также зависеть от их положения в периодической системе Менделеева.
Например, элементы в одной группе имеют общие химические свойства, так как у них одинаковое количество внешних электронов. Это позволяет им образовывать аналогичные соединения и реагировать с другими элементами похожим образом.
Химические свойства элементов в периодической системе Менделеева также помогают предсказать и объяснить их поведение в различных химических реакциях. Это имеет важное значение для разработки новых материалов, лекарственных препаратов и многих других областей науки и промышленности.
В целом, изучение химических свойств элементов в периодической системе Менделеева является фундаментальным вопросом химии и имеет огромное значение для понимания и применения химических процессов в различных областях науки и технологии.
Порядковые числа и периоды

Периоды в таблице Менделеева представлены горизонтальными рядами, их всего семь. Первый период состоит из двух элементов - водорода (H) и гелия (He), второй период - из восьми элементов, третий - из 8 элементов, и так далее. Всего в таблице Менделеева представлено 118 элементов, расположенных в 7 периодах.
- Первый период (K-подобная группа): H (водород) и He (гелий).
- Второй период (Li-подобная группа): Li (литий), Be (бериллий), B (бор), C (углерод), N (азот), O (кислород), F (фтор), Ne (неон).
- Третий период (Na-подобная группа): Na (натрий), Mg (магний), Al (алюминий), Si (кремний), P (фосфор), S (сера), Cl (хлор), K (калий), Ar (аргон).
- Четвёртый период (K-подобная группа):K (калий), Ca (кальций), Sc (скандий), Ti (титан), V (ванадий), Cr (хром), Mn (марганец), Fe (железо), Co (кобальт), Ni (никель), Cu (медь), Zn (цинк), Ga (галлий), Ge (германий), As (мышьяк), Se (селен), Br (бром), Kr (криптон).
- Пятый период (Rb-подобная группа): Rb (рубидий), Sr (стронций), Y (иттрий), Zr (цирконий), Nb (ниобий), Mo (молибден), Tc (технеций), Ru (рутений), Rh (родий), Pd (палладий), Ag (серебро), Cd (кадмий), In (индий), Sn (олово), Sb (сурьма), Te (теллур), I (иод), Xe (ксенон).
- Шестой период (Cs-подобная группа): Cs (цезий), Ba (барий), La (лантан), Hf (гафний), Ta (тантал), W (вольфрам), Re (рений), Os (осмий), Ir (иридий), Pt (платина), Au (золото), Hg (ртуть), Tl (таллий), Pb (свинец), Bi (висмут), Th (том), U (уран), Np (нептуний), Pu (плутоний), Am (америций), Cm (курий), Bk (берклий), Cf (кальфорний), Es (эйнштейний), Fm (фермий), Md (менделевий), No (нобелий), Lr (лоренсий).
- Седьмой период (Fr-подобная группа): Fr (франций), Ra (радий), Ac (актиний), Rf (резерфордий), Db (дубний), Sg (сиборгий), Bh (борий), Hs (хассий), Mt (мейтнерий), Ds (дармштадтий), Rg (рентгений), Cn (коперниций), Nh (нихоний), Fl (флеровий), Mc (московий), Lv (ливерморий), Ts (теннессин), Og (оганесон).
Порядковые числа и периоды помогают классифицировать и систематизировать элементы в таблице Менделеева, образуя основу для изучения и понимания химических свойств и регулярностей в поведении элементов.
Применение периодической системы элементов Менделеева
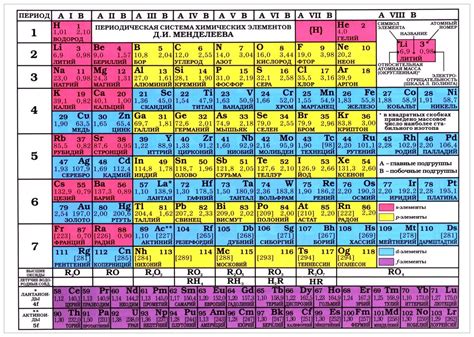
Применение периодической системы Менделеева включает следующие аспекты:
Организация элементов
Периодическая система Менделеева структурирует все известные элементы в порядке их атомных номеров и химических свойств. Она располагает элементы в таблице, разделенной на периоды (горизонтальные строки) и группы (вертикальные колонки). Такая организация позволяет быстро находить нужный элемент и получать информацию о его свойствах.
Предсказание свойств элементов
Установление закономерностей между элементами
Периодическая система Менделеева позволяет обнаружить связи и закономерности между элементами. Например, элементы в одной группе обладают схожими химическими свойствами, в то время как элементы в одном периоде имеют схожее количество электронных оболочек.
Представление информации о химических элементах
Периодическая система Менделеева предоставляет компактную и удобную форму представления информации о химических элементах. Она содержит данные о массе атома, атомном номере, химическом символе и других характеристиках. Это позволяет исследователям быстро находить нужные данные и проводить анализ химических свойств элементов.
В итоге, периодическая система элементов Менделеева являет собой фундаментальный инструмент для химиков, физиков и других ученых, позволяющий организовать, предсказывать и исследовать свойства химических элементов.