Аммиак (NH3) и метан (CH4) - два различных газа с разными свойствами и структурами молекул. Однако, главное отличие между ними заключается в их молекулярной полярности.
Как известно, аммиак является полярным молекулой, это означает, что у него есть разница в распределении электронов внутри молекулы, что приводит к наличию положительного и отрицательного зарядов. Положительно заряженный атом водорода притягивает электроны и отталкивает их от своего отрицательно заряженного атома азота.
Эта полярность делает аммиак легко растворимым в воде, поскольку вода также является полярным растворителем. Между молекулами аммиака и воды возникают водородные связи, которые взаимодействуют между собой, образуя устойчивое растворение.
Аммиак и его растворение в воде

Вода (H2O) является поларным молекулой, что означает, что она имеет неравномерное распределение зарядов внутри молекулы. Это приводит к тому, что положительный заряд находится ближе к водородным атомам, а отрицательный заряд – к кислородному атому. Полярность молекулы воды делает ее способной притягивать и взаимодействовать с другими полярными или ионными веществами.
Вода и аммиак, как полярные молекулы, проявляют схожие свойства в растворении друг в друге. При контакте аммиака с водой происходит химическая реакция, в результате которой образуется ионный комплекс NH4OH (а также некоторое количество ионов NH4+ и OH-). Это явление называется гидратацией аммиака или растворением аммиака.
Растворенный аммиак может проявлять свои особенности, такие как щелочность и амфотерный характер. Раствор аммиака в воде используется в различных отраслях науки и промышленности, включая химическую, медицинскую и сельскохозяйственную области.
| Свойство | Аммиак | Метан |
|---|---|---|
| Состояние при комнатной температуре и давлении | Газ | Газ |
| Растворимость в воде | Растворим | Малорастворим |
| Полярност | Полярный | Неполярный |
| Известные применения | Производство удобрений, лекарств, чистящих средств, холодильных систем | Горючее в природном газе, производство пластика, электричества |
В заключении, аммиак растворим в воде из-за их схожей полярности и возможности образования ионного комплекса. Это позволяет аммиаку проявлять ряд химических свойств и быть полезным в различных областях применения. Наоборот, метан, как неполярный газ, мало растворяется в воде и имеет совсем другие свойства и применения.
Метан и его низкая растворимость

Одно из них - его низкая растворимость в воде. Метан практически не растворяется в воде и образует лишь слабое слоистое взаимодействие. Это происходит из-за различных химических и физических свойств молекулы метана и молекулы воды.
Молекула метана имеет аполярную структуру, состоящую только из атомов углерода и водорода. В то же время, молекула воды является полярной, с положительно заряженным атомом водорода и отрицательно заряженными атомами кислорода.
Полярность молекулы воды значительно затрудняет растворение неполярного метана. Межмолекулярные силы, называемые ван-дер-Ваальсовыми силами, являются главным источником взаимодействия между молекулами метана и молекулами воды. Однако, эти силы слабы, и поэтому метан остается практически нерастворимым в воде.
Несмотря на это, в небольших количествах метан может растворяться в воде при высоком давлении и низких температурах. Например, при чрезвычайно низких температурах и высоких давлениях, метан может образовать кристаллические структуры в воде, что наблюдается в арктических морях и ледниках.
Таким образом, низкая растворимость метана в воде обусловлена его неполярной структурой и отсутствием сильных межмолекулярных сил притяжения между молекулами метана и молекулами воды.
Молекулярные свойства аммиака
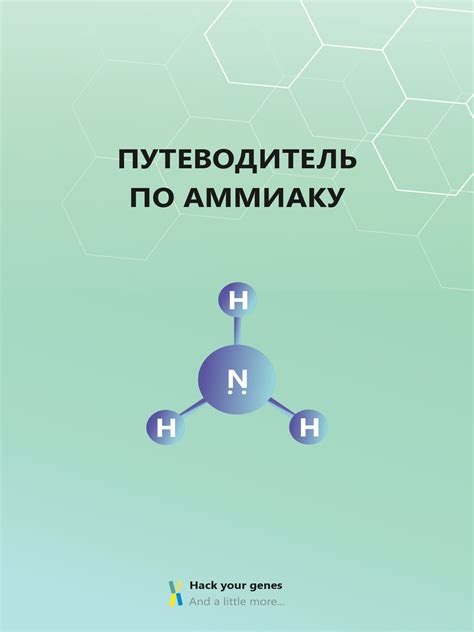
Молекулы аммиака имеют форму пирамиды, где атом азота является вершиной, а атомы водорода – основаниями. На этой пирамиде есть одна непарная электронная пара азота. Эта электронная пара притягивает электроны от водородных атомов и создает полярную ковалентную связь.
Из-за полярной структуры молекулы аммиака, возникает электроотрицательность – разница в распределении электронной плотности. Негативный заряд сосредоточен около атома азота, в то время как положительный заряд распределен на атомах водорода. Благодаря этому аммиак является полюсным соединением.
При растворении аммиака в воде, полярные молекулы аммиака и молекулы воды формируют водородные связи. Водородные связи возникают между положительным водородным атомом воды и отрицательно заряженным атомом азота аммиака, и между отрицательно заряженным кислородом воды и положительными водородными атомами аммиака.
Это взаимодействие образует стабильную молекулярную сеть, которая разрушается только при нагревании или высыхании раствора. В результате растворность аммиака в воде достаточно высока.
Однако, в отличие от аммиака, метан – это неполярное соединение. Молекулы метана не имеют никаких зарядов и не способны формировать водородные связи с молекулами воды. Поэтому метан практически не растворяется в воде и считается малорастворимым.
Таким образом, молекулярные свойства аммиака, включая его полярность и возможность образования водородных связей, обуславливают его высокую растворимость в воде.
Молекулярные свойства метана

Молекула метана имеет форму тетраэдра, в котором четыре атома водорода равномерно расположены вокруг центрального атома углерода. Метан является неполярной молекулой, так как все связи между атомами имеют одинаковую полярность и направлены в одну сторону.
Благодаря своей неполярности, метан слабо взаимодействует с полярными растворителями, включая воду. Это объясняет его малую растворимость в воде. Несмотря на то, что метан может образовывать слабые взаимодействия, такие как ван-дер-ваальсовы силы, с молекулами воды, эти взаимодействия не достаточно сильны для образования устойчивого раствора. Как результат, метан остается малорастворимым в воде.
Важно отметить, что аммиак (NH3) имеет полярную молекулу, так как атом азота более электроотрицателен, чем атом водорода. Полярность аммиака позволяет ему образовывать сильные водородные связи с молекулами воды, что делает его растворимым в воде.
Межмолекулярные взаимодействия в аммиаке
Межмолекулярные взаимодействия в аммиаке основаны на двух принципах. Во-первых, молекулы аммиака обладают полярными ковалентными связями, так как аммиак имеет определенную дипольную моменту на основе различий в электроотрицательности атомов водорода и азота. Это делает аммиак полемагнитным и способствует его взаимодействию с другими полярными молекулами, такими как вода.
Во-вторых, аммиак способен образовывать водородные связи с другими молекулами. Водородные связи являются сильными электростатическими взаимодействиями между атомом водорода и электронными облаками атомов кислорода, азота или фтора. Аммиак содержит один атом водорода, который может образовывать водородные связи. Это позволяет аммиаку образовывать водородные связи с водой и значительно увеличивает его растворимость в воде.
Эти межмолекулярные взаимодействия делают аммиак растворимым в воде, в то время как метан (CH4) не обладает полярными связями и не может образовывать водородные связи. Поэтому метан плохо растворим в воде и обычно образует нестабильный газовый раствор.
Межмолекулярные взаимодействия в метане
Ван-дер-Ваальсовы силы возникают между неполярными молекулами, такими как метан. Эти силы обусловлены возникновением временных диполей в молекулах, вызванных флуктуацией в электронном облаке. В результате, эти диполи притягивают соседние молекулы и создают слабое молекулярное притяжение.
Однако, вода (H2O) является поларным соединением, благодаря наличию полярной связи O-H. Межмолекулярные взаимодействия воды включают водородные связи, которые сильнее ван-дер-Ваальсовых сил. Водородные связи возникают между атомом водорода одной молекулы и атомом кислорода другой молекулы.
Таким образом, метан не образует водородных связей с молекулами воды и не обладает полярностью, что делает его малорастворимым в воде. В то же время, аммиак (NH3) обладает полярной связью и может образовывать водородные связи с молекулами воды, что делает его растворимым в воде.
| Соединение | Межмолекулярные взаимодействия |
|---|---|
| Метан (CH4) | Ван-дер-Ваальсовы силы |
| Аммиак (NH3) | Ван-дер-Ваальсовы силы и водородные связи |
| Вода (H2O) | Водородные связи |
Симметрия и полярность молекул
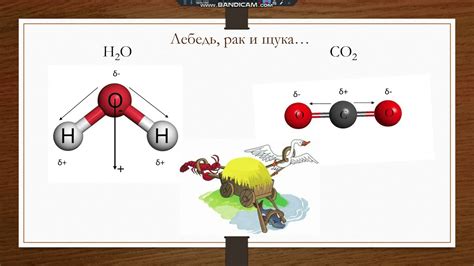
Симметричные молекулы, такие как метан (CH4), обладают нулевой дипольным моментом и являются неполярными. Внутри молекулы метана углерод-водородные связи равномерно распределены вокруг центрального атома углерода. Поэтому метан плохо растворяется в воде, которая является полярным растворителем.
В отличие от метана, молекула аммиака (NH3) имеет треугольную пирамидальную форму в следствие наличия одной свободной пары электронов на атоме азота. Это создает неравномерное распределение зарядов внутри молекулы и приводит к образованию диполя. Аммиак обладает полярностью и способен образовывать водородные связи с молекулами воды, что обеспечивает его хорошую растворимость в воде.
Вода как растворитель
Вода обладает полярной структурой, так как молекулы воды имеют дипольный характер. Они состоят из одного атома кислорода, обладающего отрицательным зарядом, и двух атомов водорода с положительным зарядом.
Из-за полярной структуры, вода обладает возможностью образования водородных связей с другими молекулами воды или с другими полярными веществами. Это делает ее способной растворять более 100 различных веществ, включая соли, кислоты, щелочи и ряд органических соединений.
Растворение в воде происходит посредством образования гидратной оболочки вокруг растворяемых молекул. Молекулы воды образуют водородные связи с молекулами растворенного вещества, что позволяет его равномерно распределить в водном растворе.
Кроме того, вода обладает высокой теплоемкостью и теплопроводностью, что способствует равномерному распределению тепла в растворе. Это позволяет воде эффективно поглощать и отдавать тепло при растворении веществ, что влияет на скорость и интенсивность растворения.
Метан, в отличие от аммиака, является неполярной молекулой. Он не образует водородные связи с молекулами воды и не может образовать гидратную оболочку. Это объясняет его низкую растворимость в воде.
Таким образом, вода обладает уникальными свойствами, которые делают ее эффективным растворителем для многих веществ. Ее полярная структура и способность образовывать водородные связи играют ключевую роль в растворении различных солей и органических соединений. В то же время, неполярные молекулы, такие как метан, малорастворимы в воде и не могут полностью раствориться в ней.



