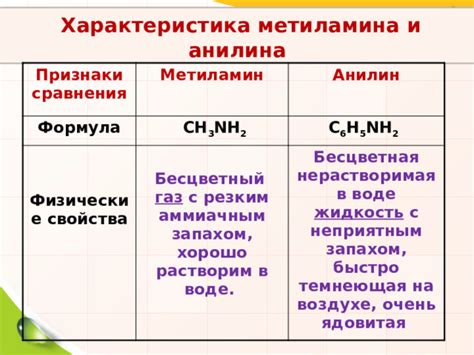
Анилин – это ароматическое соединение, используемое в промышленности для производства красителей, пластмасс, фармацевтических средств и других продуктов. Однако, несмотря на широкое применение, анилин плохо растворим в воде, что ограничивает его использование в некоторых областях.
Причина нерастворимости анилина в воде заключается в его химической структуре. Анилин состоит из ароматического кольца бензола, к которому присоединена амино-группа (NH2). Вода, в свою очередь, является полярным растворителем, поскольку имеет дипольную структуру, состоящую из двух положительно и отрицательно заряженных концов (H2O).
Высокая нерастворимость в воде обусловлена поларностью веществ, то есть наличием полярных связей. В случае анилина, отсутствие полярных групп в молекуле негативно влияет на его растворимость в воде. Амино-группа в анилине является неполярной, поскольку электроотрицательность азота (3,04) и углерода (2,55) примерно одинакова. Такой промежуточный характер электроотрицательности атомов обуславливает аполярность молекулы в целом.
Причины нерастворимости анилина в воде
1. Гидрофобность:
Анилин содержит большую ароматическую часть, состоящую из бензольного кольца. Ароматическая система обладает гидрофобными свойствами и тяготеет к другим гидрофобным веществам. Вода, в свою очередь, является полярным растворителем и обладает молекулярной полярностью. Гидрофобные соединения имеют тенденцию отталкиваться от воды и предпочитают образовывать агрегаты или собственные межмолекулярные силы. Данное свойство гидрофобности оказывает существенное влияние на нерастворимость анилина в воде.
2. Загущающая способность:
Аминогруппа анилина, обладая высоким электроноакцепторным свойством, может образовывать ассоциативные связи, которые способствуют загущению раствора. Эти связи предотвращают полное растворение молекул анилина в воде.
3. Водородная связь:
Водородные связи - это межмолекулярные силы, которые обычно происходят между положительно заряженной водородной атомом и отрицательно заряженным атомом оре ореода. Амино-группа в анилине, которая содержит водород, может участвовать в образовании водородных связей с молекулами воды. Однако эти водородные связи недостаточно сильны для обеспечения полного растворения анилина.
Полярность молекулы анилина
Полярность молекулы определяется разностью электроотрицательности атомов в составе соединения. В анилине аминогруппа имеет атом азота, который является электроотрицательным. Кольцевой атом углерода является менее электроотрицательным. Однако, разность электроотрицательности между ними невелика, что приводит к небольшой полярности молекулы анилина.
Тем не менее, чтобы молекула была полностью полярной, необходимо, чтобы атомы с разными электроотрицательностями находились в разных концах молекулы и образовывали диполь. В случае анилина, аминогруппа и ароматическое кольцо находятся близко друг к другу и создают более слабую полярность. Это делает анилин нерастворимым в поларных растворителях, таких как вода, где требуется сильная полярность для образования водородных связей с молекулами воды.
Таким образом, отсутствие достаточной полярности в молекуле анилина является основной причиной его нерастворимости в воде.
Гидратация анилина

Гидратация – это процесс, в результате которого молекулы вещества образуют взаимодействие с молекулами воды. При гидратации поларные молекулы воды окружают молекулы вещества, образуя гидратные оболочки. Однако, в случае с анилином, наличие ароматического кольца препятствует эффективной гидратации молекул данного соединения.
Ароматическое кольцо анилина формирует плоскую структуру с высокой электронной плотностью, что делает ароматическое кольцо электрон-дефицитным и малоподвижным. Это свойство ведет к слабым взаимодействиям между молекулами воды и анилином, что приводит к низкой растворимости анилина в воде.
Однако, анилин может подвергаться частичной гидратации в результате образования непрочных водородных связей с водой. Несмотря на это, растворимость анилина в воде остается низкой, что обусловлено слабыми взаимодействиями между молекулами анилина и молекулами воды.
Гидратация анилина в органических растворителях значительно выше, поскольку органические растворители не образуют таких сильных водородных связей, как вода. Это позволяет молекулам органического растворителя проникать в ароматическое кольцо анилина и образовывать стабильные взаимодействия, что ведет к повышенной растворимости анилина в органических растворителях.
Водородные связи
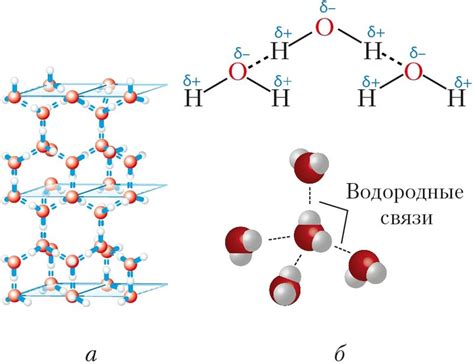
В случае с водородом, вода обладает высокой электроотрицательностью, поэтому она может образовывать водородные связи с другими молекулами воды или с другими веществами. Однако, анилин, содержащий атомы азота, не обладает такой же высокой электроотрицательностью, что делает его неспособным к образованию водородных связей с водой.
Водородные связи обладают большой силой притяжения и значительно влияют на физические свойства вещества. Различия в способности образования водородных связей могут быть одной из причин различий в растворимости между разными веществами, такими как анилин и вода.
Формирование мицелл
При взаимодействии с водой, молекулы анилина ориентируются таким образом, чтобы его гидрофильная аминогруппа взаимодействовала с молекулами воды, а гидрофобный ароматический фрагмент оставался вне области контакта с водой.
Однако, при достаточно высокой концентрации анилина в воде, происходит образование мицелл. Мицеллы - это структуры, образованные из агрегированных молекул вещества. В случае анилина, мицеллы образуются из анилиновых молекул, где гидрофобные ароматические фрагменты сосредоточены внутри мицеллы, а гидрофильные аминогруппы наружу, взаимодействуя с молекулами воды.
Формирование мицелл позволяет анилину раствориться в воде до определенной концентрации. Это явление приводит к увеличению растворимости анилина и расширению его спектра применения в различных областях, включая химическую, фармацевтическую и косметическую промышленность.



