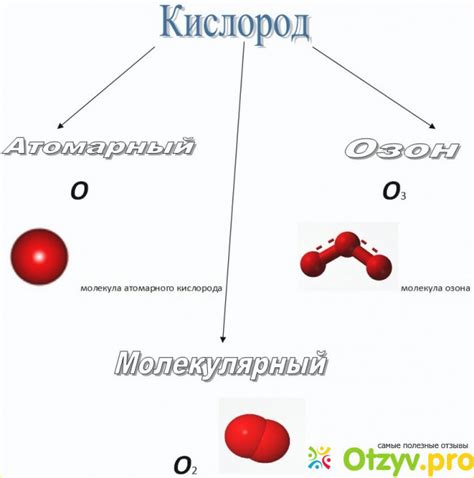
Кислород – один из самых важных химических элементов, который играет решающую роль в поддержании жизни на Земле. Он находится в воздухе в виде двух основных форм – атомарного и молекулярного кислорода. Тем не менее, атомарный кислород активнее реагирует с другими веществами, чем его молекулярная форма.
Основное различие между атомарным и молекулярным кислородом заключается в их структуре. Молекулярный кислород состоит из двух атомов, связанных ковалентной связью. В свою очередь, атомарный кислород представляет собой один отдельный атом. Такая разница в структуре влияет на их способность к химическим реакциям.
Атомарный кислород обладает высокой энергией и стремится установить стабильность, образуя связи с другими атомами. Этот процесс называется окислением. В результате окисления атомарный кислород может образовывать целую цепочку химических реакций, способных изменить свойства вещества, с которым он взаимодействует.
Молекулярный кислород, в свою очередь, менее активен из-за своей структуры. Молекула кислорода относительно стабильна и не обладает такой высокой энергией, как атомарный кислород. Поэтому молекулярный кислород реагирует медленнее и требует более сильных условий, чтобы начать химическую реакцию.
Таким образом, атомарный кислород проявляет большую активность и легче реагирует с другими веществами, чем молекулярный кислород. Это связано с различием в их структуре и энергии. Знание об этой разнице помогает понять, почему атомарный кислород широко применяется в химических реакциях и процессах, связанных с жизнедеятельностью организмов, и его использование играет важную роль в нашей повседневной жизни.
Атомарный кислород: легкость реакции
Атомарный кислород, в отличие от молекулярного, реагирует легче и более активно. Это происходит из-за присутствия свободных радикалов в его структуре. Атомарный кислород обладает непарными электронами, что делает его очень реакционноспособным.
Когда атомарный кислород вступает в реакцию, его непарные электроны могут легко принять или отдать электроны другим атомам или молекулам. Это позволяет атомарному кислороду участвовать в широком спектре химических реакций.
Одной из наиболее известных химических реакций, в которых участвует атомарный кислород, является окисление. Атомарный кислород может быть электрофильным, что означает, что он имеет склонность принимать электроны от других молекул или атомов. В результате окислительной реакции атомарный кислород образует оксигенные соединения, включая воду и оксиды различных элементов.
Благодаря своей активности, атомарный кислород широко используется в различных областях, таких как химическая промышленность, металлургия, медицина и экология. Например, атомарный кислород используется в процессе очистки сточных вод, в производстве сварочных газов, а также в медицинской терапии и дезинфекции.
Таким образом, атомарный кислород, благодаря своей реакционной способности, позволяет участвовать во множестве химических реакций и находит широкое применение в различных областях.
Строение атомарного кислорода
Атомарный кислород представляет собой молекулу, состоящую из двух атомов кислорода (O). Он обычно встречается в природе в виде двухатомных молекул и входит в состав молекул воздуха. Однако в определенных условиях, таких как высокие температуры или высокое давление, атомарный кислород может образовываться и находиться в отдельном состоянии.
У атомарного кислорода есть своя уникальная электронная конфигурация. Каждый атом кислорода имеет 8 электронов, из которых 2 находятся в первом энергетическом уровне, а 6 - во втором. Эта конфигурация делает атомарный кислород стабильным и независимым.
За счет своей структуры, атомарный кислород легко реагирует с другими веществами и образует различные химические соединения. Поскольку атомарный кислород не связан с другими атомами кислорода, в отличие от молекулярного кислорода, он имеет большую реакционную способность и может вступать в химические реакции с другими веществами более легко.
Атомарный кислород играет важную роль во многих химических процессах, таких как сгорание и окисление. Он является необходимым компонентом для поддержания жизни на Земле и играет ключевую роль в дыхании организмов.
Энергетические особенности

Реакции атомарного и молекулярного кислорода существенно различаются из-за их энергетических особенностей.
Атомарный кислород (O) обладает возможностью образования двойных связей и имеет неболее высокую энергию, чем молекулярный кислород (O2), что делает его более активным.
Во время химической реакции атомарный кислород адсорбирует энергию, что увеличивает его реакционную способность. Одна из особенностей атомарного кислорода заключается в его возможности индуцировать механизм перекисного окисления, который позволяет эффективнее и быстрее разрушать химические связи в органических молекулах.
Молекулярный кислород, в свою очередь, не обладает такой способностью индукции, так как он не может образовывать двойные связи с другими молекулами. Это делает его менее активным при химических реакциях. Кроме того, для реакции молекулярного кислорода требуется значительно больше энергии, что препятствует их непосредственной реакции с органическими веществами.
Энергетические особенности атомарного и молекулярного кислорода определяют их различные химические свойства и способность взаимодействовать с другими веществами.
| Атомарный кислород | Молекулярный кислород |
|---|---|
| Образование двойных связей | Отсутствие возможности образования двойных связей |
| Высокая реакционная способность | Меньшая активность при химических реакциях |
| Возможность индуцировать перекисное окисление | Не обладает способностью индукции |
Взаимодействие с другими веществами
Атомарный кислород (О) легче реагирует с другими веществами по сравнению с молекулярным кислородом (O2) из-за различной природы их химической структуры.
Атомарный кислород - это отдельный атом кислорода, в то время как молекулярный кислород состоит из двух атомов, связанных ковалентной связью. Эта разница в структуре делает атомарный кислород более активным и реакционноспособным в сравнении с молекулярным кислородом.
Атомарный кислород может вступать в реакцию с другими веществами, образуя химические связи. Он обладает высокой реакционной способностью и может взаимодействовать с различными элементами и соединениями.
Например, атомарный кислород может реагировать с металлами, образуя оксиды. Он также может окислять органические соединения, например, алкены и алканы. Взаимодействие атомарного кислорода с веществами способствует многим химическим реакциям и процессам, которые играют важную роль в природе и промышленности.
В свою очередь, молекулярный кислород, благодаря своей структуре, менее активен и реакционноспособен. Его расщепление требует больше энергии, и реакции с другими веществами протекают медленнее по сравнению с атомарным кислородом.
Таким образом, различия в химической структуре атомарного и молекулярного кислорода определяют их различную реакционную способность и влияют на их взаимодействие с другими веществами.