Атомный радиус - один из важных характеристик атома, который показывает его размер. Интересно то, что атомный радиус увеличивается при движении вниз по периодической таблице и уменьшается при движении слева направо. В этой статье мы рассмотрим причины такого поведения атомного радиуса.
Основная причина уменьшения атомного радиуса слева направо заключается в изменении электронной структуры атома. В периодической таблице элементы расположены в порядке увеличения атомного номера. При движении от левого края таблицы к правому атомы получают дополнительные электроны, которые занимают места внешних энергетических оболочек.
Дополнительные электроны, занимающие места во внешних оболочках, создают сильное электронное отталкивание, из-за которого атом сжимается. Электроны внешней оболочки отталкиваются друг от друга, что приводит к уменьшению размера атома. Это обусловлено тем, что при движении слева направо атом становится более электронегативным и притягивает больше электронов к своей внешней оболочке.
Почему уменьшается атомный радиус слева направо
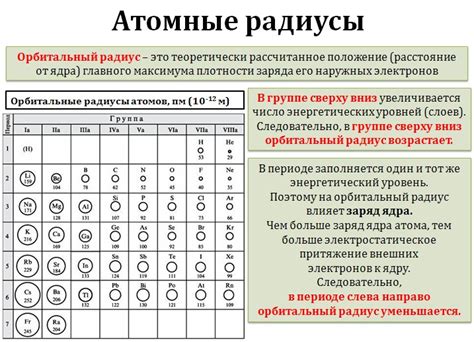
Атомный радиус указывает на размер атома и определяется расстоянием от ядра до внешней оболочки электронов. Уменьшение атомного радиуса слева направо в периоде периодической системы элементов объясняется несколькими факторами.
- Эффективная заряд ядра: С увеличением атомного номера, число протонов в ядре увеличивается. Каждый протон имеет положительный заряд, который притягивает электроны к ядру. Следовательно, с увеличением эффективной заряда ядра, электроны сильнее притягиваются к нему, что приводит к уменьшению атомного радиуса.
- Экранирование электронов: При увеличении атомного номера, количество электронов в оболочке также увеличивается. Электроны внутренних оболочек создают эффект экранирования, который ослабляет притяжение ядра к внешним электронам. Однако, в данном периоде число внутренних электронов остается постоянным, поэтому экранирование незначительно, ведя к уменьшению атомного радиуса.
- Энергетические уровни электронов: При движении вправо в периоде, количество электронов во внешней оболочке остается постоянным, но энергия их уровней возрастает. Это связано с увеличением эффективной зарядности ядра. Более высокие энергетические уровни делают электроны менее плотными и менее удаленными от ядра, что в свою очередь уменьшает атомный радиус.
Таким образом, комбинация эффективного заряда ядра, экранирования электронов и энергетических уровней электронов объясняет уменьшение атомного радиуса слева направо в периоде периодической системы элементов.
Закономерности периодической системы Менделеева
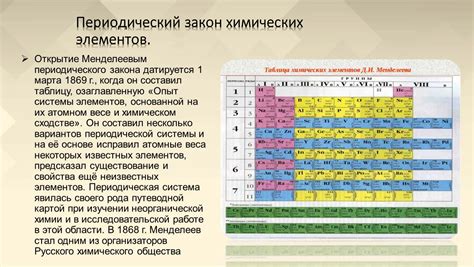
Периодическая система Менделеева состоит из строк, называемых периодами, и столбцов, называемых группами. Каждый элемент располагается в определенном месте таблицы и имеет свой уникальный атомный номер, символ и атомный радиус.
Закономерности в периодической системе Менделеева связаны с изменением атомных свойств элементов по мере движения отлева направо по периоду и сверху вниз по группе. Самая заметная закономерность - изменение размеров атомов.
| Группа | Период 1 | Период 2 | Период 3 | ... |
|---|---|---|---|---|
| 1 | H | Li | Na | ... |
| 2 | Be | B | Mg | ... |
| 3 | ... | ... | ... | ... |
| ... | ... | ... | ... | ... |
Следует отметить, что при движении по периоду с лева направо атомный радиус уменьшается. Это связано с увеличением количества протонов и электронов в атоме, а также с эффектом экранирования, вызванного соседними электронными оболочками.
Например, атомный радиус увеличивается по мере движения от лития (Li) к фтору (F) во втором периоде. Это объясняется тем, что при переходе от лития к фтору количество электронных оболочек остается одинаковым, но атомный радиус увеличивается за счет увеличения числа электронов внутри внешней оболочки.
В целом, закономерности периодической системы Менделеева позволяют нам более глубоко понять строение и свойства элементов, что имеет важное значение для различных областей науки и технологий, включая химию, физику и материаловедение.
Увеличение заряда ядра атома

Когда перемещаемся слева направо в периоде, атомный радиус уменьшается. Это объясняется увеличением заряда ядра атома. Следует отметить, что атомный радиус определяется не только зарядом ядра, но и количеством электронных оболочек и их взаимодействием. Тем не менее, увеличение заряда ядра является основной причиной уменьшения атомного радиуса.
Увеличение заряда ядра атома приводит к усилению притяжения между ядром и электронами, что делает атом более компактным. С увеличением числа протонов в ядре атом становится более положительно заряженным и притягивает электроны сильнее.
Например, атомы натрия (Na) и магния (Mg) находятся в одном периоде. У атома натрия 11 протонов, а у атома магния 12 протонов. Заряд ядра магния больше, поэтому атомный радиус магния меньше, чем радиус натрия.
Таким образом, увеличение заряда ядра атома при движении слева направо в периоде приводит к уменьшению атомного радиуса.
Влияние электронной конфигурации

Электронная конфигурация атомов элементов определяет, как электроны распределены вокруг ядра атома. Различные элементы имеют разную электронную конфигурацию, что оказывает влияние на размер атомного радиуса.
При движении слева направо в периодической таблице элементов, атомный радиус уменьшается. Это происходит из-за изменения электронной конфигурации. Количество протонов в ядре атома увеличивается на каждом шаге вправо, но неполные энергетические уровни не меняются. Каждый элемент в периоде имеет одинаковое количество энергетических уровней, но разное количество электронов.
Электроны на более внешних энергетических уровнях находятся дальше от ядра и слабее притягиваются к ядру, чем электроны на более близких энергетических уровнях. Поэтому атомный радиус увеличивается с увеличением количества энергетических уровней. Однако, когда количество электронов на внешних энергетических уровнях остается постоянным, атомный радиус уменьшается при увеличении количества протонов в ядре.
В результате, элементы в левой части периодической таблицы имеют больший атомный радиус, чем элементы в правой части. Примеры такого уменьшения атомного радиуса от левого к правому: литий, бериллий, гелий, бор, углерод и так далее.
Эффект экранирования
В атоме каждый следующий электрон занимает энергетически более высокий уровень, но также вносит свой вклад в экранирование ядра. Электроны, находящиеся ближе к ядру, образуют электронные облака, которые фактически защищают внешние электроны от притяжения ядра. Из-за этого феномена, каждое следующее электронное облако слабее экранирует ядро от внешних электронов. Следовательно, более близкие к ядру электроны ощущают более сильное притяжение со стороны ядра, что приводит к уменьшению размеров атома.
Для наглядного представления эффекта экранирования, можно рассмотреть элементы из одной группы в периодической системе. Например, в первой группе находятся литий, натрий, калий и так далее. Литий имеет один электрон в внешней оболочке, натрий - два, а калий - три. За счет роста числа электронов внутренних оболочек, более внешние электроны оказываются экранированы и подвержены меньшему притяжению со стороны ядра. В результате, радиус атома увеличивается в группе, поскольку увеличивается количество оболочек и электронных облаков, защищающих внешние электроны.
| Период | Группа | Эффект экранирования | Атомный радиус |
|---|---|---|---|
| 2 | 1 | Сильное экранирование | Большой радиус |
| 3 | 1 | Умеренное экранирование | Средний радиус |
| 4 | 1 | Слабое экранирование | Маленький радиус |
Таким образом, эффект экранирования сочетается с другими факторами, такими как заряд ядра и количество электронов в атоме, чтобы определить атомный радиус элемента. В результате, атомный радиус уменьшается слева направо в периодической системе, что объясняется увеличением притяжения ядра к более близким к нему электронам.