Металлы являются основными строительными блоками материи и широко используются в различных сферах человеческой деятельности. Они обладают рядом уникальных химических и физических свойств, одно из которых – способность атомов металлов легко отдавать электроны. Этот процесс играет ключевую роль во многих химических реакциях, определяет электропроводность металлов и их способность образовывать сплавы.
Атомы металлов состоят из положительно заряженного ядра и облака свободно движущихся электронов. Одной из причин легкости отдачи электронов атомами металлов является особенность их электронной конфигурации. Большинство металлов находятся в левой части периодической системы элементов и имеют от одного до трех электронов в валентной оболочке. Это означает, что у атомов металлов относительно небольшая разница между энергией внутренних и внешних электронов, что позволяет им легко освобождаться.
Второй важной причиной легкости отдачи электронов атомами металлов является их атомный радиус. Металлы имеют относительно большой размер атомов, что приводит к слабой силе притяжения между ядром и внешними электронами. Это ослабляет ионный радиус металлов и создает благоприятные условия для электронных переходов.
Металлическая структура атомов

Основная особенность металлической структуры заключается в том, что в ее основе лежит сеть положительно заряженных ионов, окруженных облаком свободно движущихся электронов. Каждый атом в металле отдает несколько своих электронов в эту общую электронную оболочку, создавая электронный газ. Таким образом, металлы обладают положительным зарядом в кристаллической решетке, но в то же время содержат свободно движущиеся электроны, которые можно отделить от атомов.
Это относительно слабое привлечение между положительными ионами атомов и электронами в общей электронной оболочке создает условия для легкого отрыва электрона от атома металла. Помимо этого, свободно движущиеся электроны обладают высокой подвижностью и могут передвигаться по металлической решетке без значительных препятствий. В результате, при воздействии внешних энергетических возбуждений, таких как теплота или электрическое поле, эти электроны могут легко перейти на другие атомы металла, образуя электронный ток.
Кроме того, металлическая структура также способствует и другим химическим свойствам металлов. Благодаря свободно движущимся электронам, металлы обладают высокой теплопроводностью и электропроводностью, а также могут образовывать сплавы и легко изменять свою форму под действием внешних сил.
Электронное строение металлов
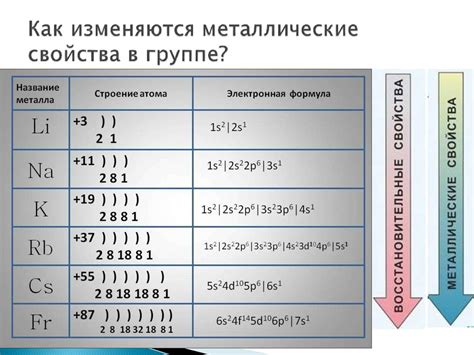
Электронное строение металлов играет ключевую роль в их способности легко отдавать электроны. Атомы металлов имеют особую структуру, в которой внешние электроны слабо привязаны к ядру.
Металлы обладают достаточно большим количеством внешних электронов, которые находятся в последних энергетических уровнях электронной оболочки. Эти электроны, называемые валентными, обладают свободной орбиталью.
В электронном строении металлов, валентные электроны далеко отстоят от ядра атома, находясь на далеких энергетических уровнях. Кроме того, они находятся в "области обмена" с другими атомами.
Это делает валентные электроны металлов слабо привязанными к ядру и позволяет им легко передвигаться между атомами.
В результате, когда внешней энергии достаточно для ионизации, металлы могут легко отдать валентные электроны и образовать положительные ионы, называемые катионами.
Важно отметить, что электронное строение металлов также определяет их способность проводить электрический ток. Благодаря наличию свободно движущихся электронов, металлы являются хорошими проводниками электричества.
Металлы как активные вещества
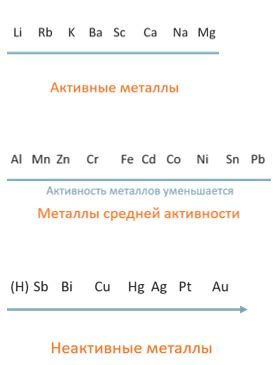
В атоме металла большинство электронов находятся в его внешней оболочке. Эти электроны, называемые валентными электронами, слабо связаны с ядром атома и могут легко перемещаться между атомами металла. Благодаря этому металлы обладают высокой электропроводностью и теплопроводностью.
Когда металл вступает в реакцию, его атомы могут отдать один или несколько валентных электронов другим атомам или молекулам. Этот процесс называется окислением. В результате окисления металла образуются положительно заряженные ионы, которые свободно перемещаются в растворе или реагируют с другими веществами.
Электронный обмен между атомами металла и другими веществами обеспечивает металлам их химическую активность. Благодаря этому металлы являются не только производными из полезных руд, но и активно используются в различных отраслях промышленности и технологии.
- Металлы широко применяются в производстве электрических проводов, контактов и электронных компонентов.
- Они используются в строительстве для создания прочных каркасов и конструкций.
- Металлы также применяются в производстве автомобилей и других транспортных средств.
- Они играют важную роль в химической промышленности для получения различных продуктов и материалов.
Таким образом, металлы являются активными веществами благодаря своей способности отдавать электроны и вступать в химические реакции. Их уникальные свойства делают их незаменимыми в различных областях нашей жизни.