При изучении химии невозможно обойти вниманием вопрос о том, почему атомы взаимодействуют друг с другом. Для полноценного понимания химических процессов необходимо разобраться в основах межатомного взаимодействия.
Атомы - это основные строительные блоки вещества. Они соединяются между собой, образуя молекулы и соединения. Взаимодействие между атомами определяет физические и химические свойства вещества.
Существуют различные виды межатомного взаимодействия: электростатическое, ковариантное и ван-дер-ваальсово. Наиболее сильное и стабильное взаимодействие возникает при обмене электронами между атомами, что приводит к образованию химических связей.
Электростатическое взаимодействие основано на притяжении или отталкивании зарядов разного знака. Это возможно благодаря наличию электронов в атомах. В случае образования химической связи электроны распределяются между атомами, что способствует их устойчивости и образованию молекул.
Ковариантное взаимодействие основано на обмене электронами между атомами. Когда один атом отдает электрон, а другой принимает, образуется ковалентная связь. Это является наиболее распространенным видом химической связи, образующимся между не металлами.
Силы ван-дер-ваальса возникают благодаря слабому притяжению между неполярными молекулами. Несмотря на свою слабость, эти силы существенно влияют на физические свойства вещества.
Взаимодействие атомов в химических процессах - ключевое образование и особенность
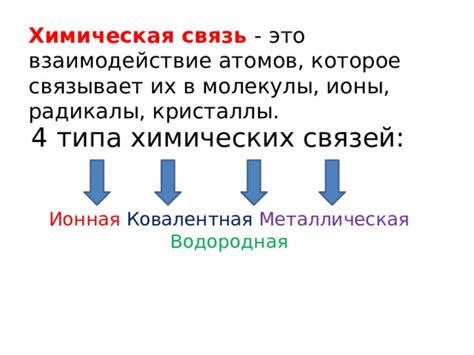
Атомы, как строительные блоки материи, играют важную роль во всех химических реакциях. Они могут связываться с другими атомами, образуя химические связи, и создавать различные соединения. Эти соединения могут быть стабильными и существовать в течение длительного времени, или быть временными и сразу же разрушаться.
Взаимодействие атомов происходит благодаря электростатическим силам притяжения и отталкивания. Атомы могут обмениваться электронами, что приводит к образованию ионов и созданию ионных связей. Также они могут делить электроны и образовывать ковалентные связи, где электроны общие для нескольких атомов.
Однако взаимодействие атомов не ограничивается только ионными и ковалентными связями. Атомы могут также притягивать или отталкивать друг друга через слабые взаимодействия, такие как ван-дер-ваальсовы силы. Эти слабые силы являются основой для существования различных соединений, включая множество органических и неорганических веществ.
Взаимодействие атомов не только позволяет образовывать различные соединения, но и определяет их физические и химические свойства. Например, взаимодействие атомов может влиять на температуру плавления и кипения вещества, его плотность, теплопроводность и многие другие свойства.
Таким образом, понимание взаимодействия атомов является неотъемлемой частью химии и позволяет нам объяснить многие явления в природе и разработать новые материалы и технологии. Изучение химических процессов помогает нам лучше понять мир вокруг нас и расширить наши возможности в области науки и промышленности.
Ковалентная связь - основа химических реакций
При образовании ковалентной связи электроны двух атомов становятся общими и образуют облако электронов. Количество общих электронов определяется валентностью атомов. Ковалентная связь устойчива и энергетически выгодна, так как атомы стараются достичь наиболее стабильной электронной конфигурации с полностью заполненными оболочками.
Ковалентная связь является ключевым элементом химических реакций и обладает рядом важных свойств. Она обеспечивает возможность образования молекул различных сложностей и структур, так как при формировании ковалентной связи атомы соединяются в определенном порядке, образуя специфическую молекулярную структуру.
Ковалентная связь также обладает определенной прочностью, что объясняет устойчивость молекулы и ее способность выдерживать различные внешние воздействия. От прочности ковалентной связи зависят физические и химические свойства вещества - его плотность, температура плавления и кипения, теплоемкость и др.
Ковалентная связь играет важную роль в химических реакциях, так как обеспечивает возможность образования новых соединений. Во время химической реакции ковалентные связи между атомами разрушаются и образуются новые, что приводит к образованию молекулы нового вещества. Это объясняет возможность синтеза новых соединений и исследования различных химических процессов.
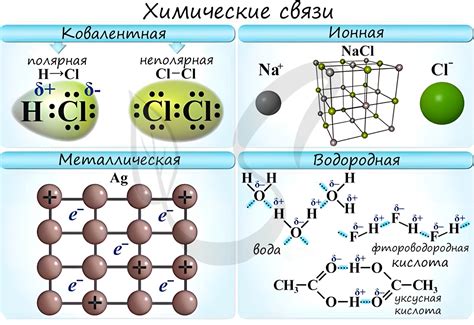
Электронный обмен создает разнообразие соединений

Одним из главных факторов, влияющих на способность атомов взаимодействовать, является валентность атома. Валентность определяет, сколько электронов может предоставить или принять атом в химической реакции. Атомы стремятся достичь электронной структуры инертного газа, полностью заполнив все свои электронные орбитали.
В результате электронного обмена, атомы могут образовывать различные типы химических связей. Самая распространенная связь - ковалентная связь, когда атомы обмениваются электронами и образуют пару общих электронов. Этот тип связи обычно происходит между неметаллическими элементами.
Другим типом связи является ионная связь, при которой атомы позволяют одному атому предоставлять электроны, а другому атому принимать электроны. При этом образуются положительно и отрицательно заряженные ионы, которые притягиваются друг к другу. Этот тип связи обычно происходит между металлическими и неметаллическими элементами.
Также существуют и другие типы связей, такие как металлическая связь, в которой электроны свободно передвигаются между атомами в металлической решетке, и водородная связь, которая образуется между атомами водорода и атомами других элементов.
Способность атомов образовывать разнообразные соединения позволяет нам создавать различные материалы и химические продукты. Это стало возможным благодаря электронному обмену, который дает атомам возможность создавать новые химические связи и обеспечивать большую стабильность и разнообразие химических соединений.
| Тип связи | Пример |
|---|---|
| Ковалентная связь | Связь между атомами кислорода в молекуле воды (H2O) |
| Ионная связь | Связь между атомами катиона натрия (Na+) и атомами аниона хлора (Cl-) в молекуле кухонной соли (NaCl) |
| Металлическая связь | Связь между атомами меди (Cu) в металлическом проводнике |
| Водородная связь | Связь между атомом водорода (H) в молекуле воды (H2O) и атомами кислорода (O) в другой молекуле воды |
Межмолекулярное взаимодействие стабилизирует вещества
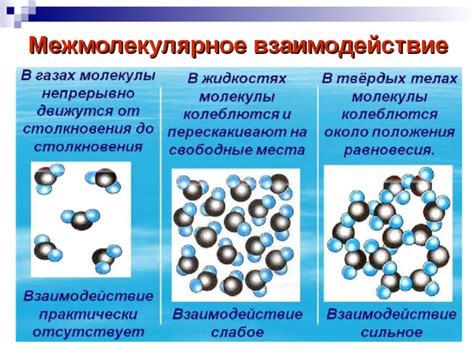
Эти взаимодействия стабилизируют молекулы и обеспечивают существование веществ в определенных физических состояниях. Благодаря межмолекулярным силам, многочисленным и разнообразным, вещества могут изменять свои физические и химические свойства.
Одной из наиболее распространенных межмолекулярных сил является ван-дер-ваальсово взаимодействие. Оно обусловлено временными изменениями электронного облака атомов и молекул, что приводит к возникновению мгновенных диполей и индуцированных диполей. Эти изменения приводят к притяжению между атомами и молекулами, что обеспечивает стабильность веществ.
Другим важным типом межмолекулярных взаимодействий является водородная связь. Водородная связь возникает между атомом водорода, участвующим в ковалентной связи с электроотрицательным атомом, и соседним электроотрицательным атомом. Водородные связи обладают высокой прочностью и влияют на многие химические и физические свойства веществ, такие как точка плавления и кипения, теплота испарения и межмолекулярная сила.
Межмолекулярные взаимодействия также играют важную роль в биологических системах. Взаимодействия между белками и молекулами в клетках определяют их функции и способствуют поддержанию жизненно важных процессов.
Таким образом, межмолекулярное взаимодействие является неотъемлемой частью химических процессов и играет важную роль в стабилизации веществ, определяя их свойства и функции.