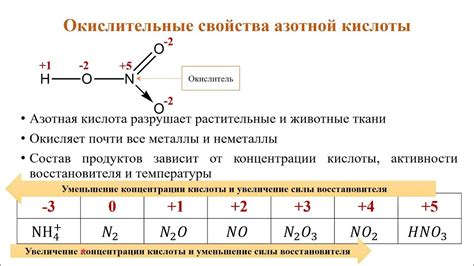
Азотная кислота (HNO3) - это одна из наиболее известных и широко используемых кислот. Она обладает сильными окислительными свойствами и широко применяется в промышленности и лабораторных условиях. Однако, в отличие от множества других кислот, азотная кислота имеет весьма ограниченную способность образовывать соли. В этой статье мы рассмотрим причины такого поведения и исследуем химические особенности азотной кислоты.
Соли - это химические соединения, образованные в результате реакции между кислотой и основанием. В общем случае, при реакции кислоты и основания образуется вода и соль. Однако, азотная кислота не образует соли с большинством оснований. Понимание этого феномена требует более глубокого изучения структуры и свойств азотной кислоты.
Основной фактор, приводящий к ограниченной способности азотной кислоты образовывать соли, состоит в ее высокой степени диссоциации. При контакте с водой, молекулы азотной кислоты распадаются на ионы, образуя гидроний (H3O+) и нитратные (NO3-) ионы. Эти ионы обладают сильной реакционной активностью и могут образовывать соединения с различными веществами.
Особенности азотной кислоты

Азотная кислота (HNO3) обладает рядом особенностей, которые делают ее высокоактивным и опасным веществом. Рассмотрим некоторые из них:
- Высокая кислотность: Азотная кислота является одной из самых сильных кислот, с кислотнос
Кислотные свойства азотной кислоты
Однако, несмотря на высокую кислотность, азотная кислота не образует соли, поскольку ее оксоанионы (нитраты) довольно нестабильны и легко распадаются. Процесс образования солей из азотной кислоты состоит из двух этапов. Сначала азотная кислота отдает свой протон, образуя оксоанион нитрат (NO3-). Однако, этот оксоанион нестабилен и склонен к дальнейшему распаду.
При образовании солей из азотной кислоты происходит сильный перекисивающий окислительный процесс, что приводит к образованию нитратов с высокой окислительной активностью. Такие оксоанионы могут вызывать даже взрывоопасные реакции.
Таким образом, азотная кислота, несмотря на свою кислотность, не образует стабильные соли из-за нестабильности оксоанионов нитратов. Эта особенность делает азотную кислоту одним из важных реагентов в химических реакциях и промышленных процессах.
Взаимодействие азотной кислоты с металлами
Азотная кислота обладает высокой степенью окислительной активности и может вступать в реакцию с многими веществами. Однако, в отличие от большинства кислот, она не образует соли с металлами. Это связано с ее особыми свойствами и реакционной способностью.
При взаимодействии азотной кислоты с металлами происходит образование оксида металла и оксида азота. Например, с медью реакция идет следующим образом:
- Медь реагирует с азотной кислотой:
- 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
- Образуется нитрат меди (Cu(NO3)2), а также оксид азота (NO) и вода (H2O).
Таким образом, азотная кислота окисляет металл, а соль металла не образуется.
Причина такого поведения азотной кислоты заключается в ее химической структуре. Молекула азотной кислоты содержит высоколабильную группу (–NO2), она обладает высокой степенью окислительной активности. В результате реакции с металлами происходит окисление металла, а соль не образуется, так как ионы металла вступают в реакцию с азотной кислотой.
Таким образом, взаимодействие азотной кислоты с металлами происходит по окислительно-восстановительным реакционным путям, при которых образуются оксиды металлов и оксиды азота, а соли металлов не образуются.