Кислоты и основания – две важные классы химических соединений, которые играют важную роль во многих процессах. Однако, взаимодействие между ними иногда не происходит путем растворения. Один из интересных примеров такого взаимодействия – реакция между кислотами и основаниями, в которой базо4, или баренцит, не растворяется в кислотах.
Баренцит, химическая формула которого BaSO4, является одним из самых растворимых осадков. Он образуется в результате реакции между растворами бария и гидросульфата или сульфата. Базо4 обладает крайне низкой растворимостью в воде – ее значительность составляет около 2 мг/литр. Это означает, что в нормальных условиях его концентрация в водном растворе практически невозможна.
Почему же базо4 не растворяется в кислотах? Ответ кроется в ионной структуре этого соединения. Базо4 состоит из ионов бария (Ba2+) и сульфата (SO42-). Когда базо4 контактирует с кислотой, например, соляной кислотой, ионы сульфата остаются нерасщепленными и не переходят в раствор.
Почему кислоты не растворяют BaSO4?

Существует несколько основных причин, почему BarsO4 не растворяется в кислотах:
| 1. | Низкая растворимость. |
| Барийсульфат, BaSO4, обладает очень низкой растворимостью в воде и других растворителях. Нефильтрованный раствор барийсульфата может быть явно виден благодаря его сложению в форме белого осадка. В связи с этим, барийсульфат оказывается неспособным растворяться в кислотной среде из-за своей низкой растворимости. | |
| 2. | Водонерастворимый слой. |
| Когда кислота вступает в контакт с барийсульфатом, происходит химическая реакция, в результате которой образуется водонерастворимый слой гидросульфата бария (Ba(HSO4)2). Этот слой накладывается на поверхности частиц BaSO4 и затрудняет дальнейшее растворение барийсульфата. | |
| 3. | Силы притяжения. |
| Частицы BaSO4 обладают сильными силами притяжения, такими как ионные связи, которые удерживают их вместе. Эта сила связи является более сильной, чем силы притяжения между частицами кислоты и BaSO4. Поэтому растворение BaSO4 в кислотах становится очень сложной задачей. |
Из-за этих причин BaSO4 не растворяется в кислотах и остается в виде нерастворимого осадка.
Химическая структура
Базо4 представляет собой неорганическое соединение, известное также как бариевый сульфат. Его химическая формула BaSO4 указывает на то, что он состоит из атомов бария (Ba), серы (S) и кислорода (O). Химическая структура Базо4 показывает, что каждый атом бария связан с четырьмя атомами кислорода, а каждый атом серы связан с одним атомом бария и тремя атомами кислорода.
Хотя бариевый сульфат является нерастворимым в большинстве кислот, его структура в значительной степени определяет его свойства. Кристаллическая структура Базо4 образуется из трехмерной решетки, в которой атомы бария занимают центральное положение и окружены атомами серы и кислорода. Эта структура обеспечивает высокую устойчивость и нерастворимость соединения.
Молекулярная или ионная структура Базо4 также играет роль в его поведении в кислотах. Когда Базо4 попадает в кислотное окружение, кислотные ионы могут реагировать с ионами бария, образуя нерастворимые соединения, такие как бариевый фосфат или бариевый карбонат. Это препятствует дальнейшему растворению Базо4 в кислотах и объясняет его нерастворимость в данном случае.
| Химический элемент | Символ |
|---|---|
| Барий | Ba |
| Сера | S |
| Кислород | O |
Реакция с кислотами

Во время реакции с кислотным раствором, молекулы сульфата бария не претерпевают никаких существенных изменений. Вследствие этого сульфат бария не растворяется во многих кислотных растворах, включая соляную кислоту (HCl), серную кислоту (H2SO4) и азотную кислоту (HNO3).
При контакте с кислотными растворами между молекулами сульфата бария и ионами водорода из кислоты образуется слабыйосадок, состоящий из не растворившихся молекул сульфата бария.
Этот осадок является результатом обратимой реакции и не растворяется в кислоте. Поэтому сульфат бария используется для определения наличия ионов бария в растворах кислот.
Таким образом, хотя сульфат бария не растворяется в кислотах, его реакция с ними является полезным методом анализа для определения наличия ионов бария в растворах.
Ионная связь

Базо4 – это соединение, образованное ионами бария (Ba2+) и сульфата (SO42-). Ионная связь между этими ионами является крайне прочной и устойчивой. Заряды ионов бария и сульфата полностью компенсируют друг друга, что создает стабильную структуру соединения.
Кислоты, в свою очередь, являются веществами, способными отдавать протоны (водородные ионы, H+). Поскольку ионная связь в BaSO4 крайне прочная, кислоты не способны разорвать эту связь и растворить BaSO4. Кислоты могут взаимодействовать с другими ионами, разрывая ионные связи и образуя новые соединения, но не в случае с BaSO4.
Растворимость ионов
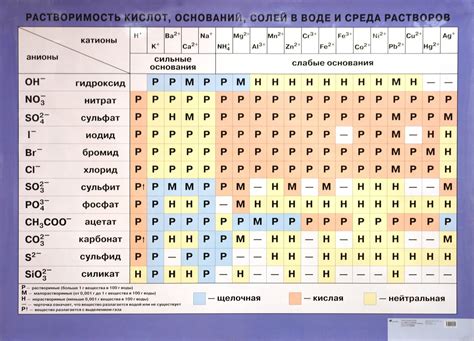
В зависимости от химической структуры ионов, их растворимость может сильно варьировать. Некоторые ионы могут хорошо растворяться в воде, образуя полностью ионизованные растворы, а некоторые практически не растворяются.
| Вещество | Растворимость в воде |
|---|---|
| Натрий (Na+) | Высокая |
| Калий (K+) | Высокая |
| Хлор (Cl-) | Высокая |
| Сульфат (SO4^2-) | Умеренная |
| Карбонат (CO3^2-) | Малая |
| Оксид (O2-) | Почти нерастворим |
Базо4 - одно из соединений, которые практически не растворяются в кислотах. При растворении в воде, его ионы (Ba^2+ и SO4^2-) образуют ионный решетчатый кристаллический осадок, который осевает в воде и не растворяется в растворителе. Это явление объясняется высокой энергией решетки и сильной взаимной связью ионов в кристаллической решетке БаSO4. Кроме того, электрические заряды ионов Со4^2- отталкивают друг друга, что также снижает растворимость соединения.
Таким образом, Базо4 имеет очень низкую растворимость в кислотах, что делает его практически не растворимым в этих растворителях и приводит к образованию осадка.
Роль воды

Вода играет важную роль в процессе растворения многих веществ, однако, в случае с базо4, она играет противоположную роль.
Кислоты в водных растворах распадаются на ионы водорода (H+) и отрицательные ионы, называемые анионами. За счет наличия в воде большого количества H+ и ОН- (гидроксидных) ионов, кислоты могут успешно диссоциировать, образуя равновесный раствор.
Однако, вещества с низкой растворимостью в воде, такие как базо4, имеют слабую связь с водой и не образуют достаточное количество ионов, чтобы происходила полная диссоциация.
Базо4, также известный как сернокислый барий, имеет низкую растворимость в воде. Когда базо4 пытаются растворить в кислотах, недостаточное количество ионов образуется и реакция не может идти. Это объясняет, почему базо4 не растворяется в кислотах.
Реакции солей

Вода является хорошим растворителем для большинства солей, так как ионы, образующие соль, разделяются в растворе и становятся доступными для реакций с другими веществами.
Однако некоторые соли, в том числе базо4, не растворяются в кислотах. Это объясняется их специфическим строением и свойствами.
Базо4 - соль, образующаяся в результате реакции между кислотой серной и основанием бария. Она обладает низкой растворимостью в воде и не растворяется в кислотах, таких как соляная кислота или серная кислота.
Это связано с тем, что барий, образующий основание, обладает высокой полярностью своих ионов. Это делает межионные связи в соли очень крепкими и трудноразрывными.
Кислоты, в свою очередь, являются протонными донорами. Они образуют связи с основанием, но не в состоянии разорвать межионные связи в соли базо4. Поэтому базо4 остается нерастворимым в кислотах.
Таким образом, реакции солей с кислотами зависят от взаимодействия между ионами соли и протонами кислоты. В случае базо4, эти взаимодействия не приводят к разрыву кристаллической решетки соли и ее растворению в кислоте.
Кислотность сплавов
- Металлические сплавы. Они могут образовывать ионы металлов, которые растворяются в кислотах, приводя к образованию соответствующих солей. Например, алюминий образует соль соляной кислоты – хлорид алюминия (AlCl3).
- Неорганические соединения. Некоторые неорганические вещества образуют кислотные растворы при взаимодействии с водой. Например, оксид серы образует серную кислоту (H2SO4) в результате контакта с водой.
- Органические соединения. Они могут быть кислотными в результате наличия функциональных групп, способных отдавать протон. Например, уксусная кислота (CH3COOH) является органическим соединением с кислотными свойствами.
Однако не все сплавы обладают кислотностью и могут растворяться в кислотах. Некоторые сплавы могут быть инертными к кислотам или даже реагировать с ними, образуя нерастворимые соединения или отказываясь отдавать протоны. Примером таких сплавов являются многие металлы и их оксиды, которые образуют защитные слои оксидных пленок и тем самым предотвращают дальнейшее взаимодействие с кислотами.
Практическое применение

Не растворяющиеся в кислотах соединения, такие как базо4, находят широкое применение в различных областях науки и промышленности.
Одним из основных практических применений базо4 является его использование в химической аналитике. Базо4 используется в качестве идентификационного реагента, так как он обладает специфическими свойствами, позволяющими определить наличие или отсутствие определенных соединений в образцах.
Базо4 также широко применяется в процессе очистки и обработки промышленных сточных вод. Он используется для удаления различных примесей и загрязняющих веществ, так как химически нерастворимое базо4 легко выделяется и удаляется из жидкости.
Еще одним важным применением базо4 является его использование в процессе производства аккумуляторов. Он используется в качестве активатора для повышения эффективности и производительности аккумуляторов. Базо4 позволяет значительно улучшить электрохимические свойства аккумуляторов, повысить их емкость и продолжительность работы.
Кроме того, базо4 находит применение в процессе производства красителей и пигментов. Он используется для придания желтого или оранжевого цвета различным материалам, таким как пластик, керамика, стекло и прочие материалы.
Важно отметить, что использование базо4 в указанных областях требует строгого соблюдения мер предосторожности, так как этот соединение может быть токсичным и вызывать различные негативные последствия для здоровья человека и окружающей среды.