Метан - это один из самых распространенных природных газов, который образуется в результате биологических и геологических процессов. Интересно, что форма его молекулы является тетраэдрической, что означает наличие четырех атомов водорода, связанных с одним атомом углерода. Такая структура обуславливает ряд уникальных свойств и химических реакций этого газа.
Тетраэдрическая форма молекулы метана связана с геометрией связей между атомами. Углеродный атом находится в центре молекулы, а атомы водорода расположены на концах равных сторон треугольника. Такая конфигурация является наиболее энергетически выгодной и стабильной для этого вещества.
Стоит отметить, что тетраэдрическая форма характерна не только для молекул метана, но и для других соединений, в которых центральный атом связан с четырьмя другими атомами.
Причины тетраэдрической формы молекулы метана
- Геометрическая оптимизация энергетического состояния молекулы. В молекуле метана все четыре валентные связи образуются между углеродом и водородом, и эти связи стремятся занять оптимальное положение, минимизируя общую энергию системы. Из всех возможных конформаций, конфигурация в виде тетраэдра оказывается наиболее энергетически выгодной.
- Размеры атомов углерода и водорода. Атомы углерода и водорода имеют отличные размеры. Атом углерода крупнее атомов водорода, при этом углерод обладает возможностью образовывать четыре связи с другими атомами. Размерные ограничения и структурные особенности позволяют молекуле метана принять форму тетраэдра.
- Электростатические взаимодействия. В молекуле метана, электрические заряды атомов водорода – положительные, а углерода – отрицательный. Благодаря такому распределению электрических зарядов, молекула метана минимизирует электростатические взаимодействия и более стабильна при тетраэдрической форме.
Таким образом, тетраэдрическая форма молекулы метана является результатом оптимизации энергетического состояния, размерных ограничений и электростатических взаимодействий. Эти причины объясняют, почему метан образует тетраэдрическую структуру.
Связь между углеродом и водородом

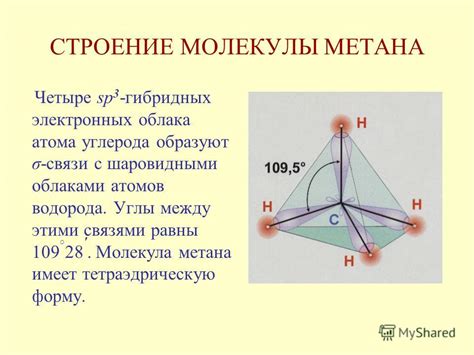
Углерод обладает четырьмя валентными электронами, которые он делит между собой и атомами водорода. Это обуславливает тетраэдрическую форму молекулы метана. Четыре электрона углерода образуют σ-связи с атомами водорода, и молекула метана приобретает симметричную форму с углами между водородными атомами, равными 109,5 градусов.
Такая угловая конфигурация является энергетически выгодной для молекулы метана. Тетраэдрическая форма позволяет каждому атому водорода находиться на максимально возможном расстоянии друг от друга, минимизируя электростатические отталкивающие силы. Это делает молекулу метана более стабильной и менее реактивной.
Связь между углеродом и водородом в молекуле метана является ковалентной и сильной. Углеродоводородные связи обладают высокой энергией и обеспечивают стабильность и прочность молекулы. Метан широко встречается в природе и используется как источник энергии, а также в производстве химических соединений.
Углеродный скелет и связи в молекуле

Углеродный скелет метана представляет собой тетраэдральную структуру, где четыре атома водорода равномерно расположены вокруг центрального атома углерода. Такая конфигурация возможна благодаря гибридизации s и p орбиталей углеродного атома.
Связи между атомами в молекуле метана представлены sigma-связями. Все связи являются ковалентными и состоят из пар электронов, которые образуются при перекрытии орбиталей углерода и водорода. Каждый атом водорода делит одну электронную пару с атомом углерода, образуя с ним силу связи.
Такая структура и связи обеспечивают метану стабильность и низкую реактивность. Кроме того, тетраэдрическая форма молекулы метана позволяет ему образовывать водородные связи и служить основным строительным блоком для более сложных органических соединений.
Углеродные и водородные атомы

Валентные электроны - это электроны во внешнем энергетическом уровне атома, которые могут участвовать в химических реакциях. Углеродный атом стремится достичь стабильной конфигурации, заполнив эти четыре валентных электрона. Для этого он делится своими электронами с атомами водорода.
Четыре атома водорода избирают такое положение, чтобы минимизировать электростатический отталкивающий эффект между ними. Это приводит к тому, что атомы водорода равномерно располагаются вокруг углеродного атома в форме тетраэдра. Такая структура молекулы метана обеспечивает минимальное энергетическое состояние системы и является наиболее устойчивой конфигурацией.
Геометрия тетраэдра

Геометрия тетраэдра тесно связана с его вытянутой формой и углом между ребрами. Углы в вершинах тетраэдра равны между собой и составляют прямой угол, то есть 90 градусов. Такая геометрия обеспечивает стабильность и прочность тела.
Форма молекулы метана, CH4, очень похожа на тетраэдр. Это связано с тем, что метановая молекула состоит из четырех атомов водорода, расположенных вокруг одного атома углерода. Углеродный атом занимает центральное положение, а четыре атома водорода равномерно располагаются по четырем углам. Следовательно, форма молекулы метана также является тетраэдрической.
Такая геометрия играет ключевую роль в химических и физических свойствах метана. Она обеспечивает максимальную устойчивость и эффективность молекулы и позволяет метану находить применение во многих научных и промышленных областях.
Распределение зарядов

Молекула метана (CH4) состоит из одного атома углерода и четырех атомов водорода.
На углеродном атоме в метане находятся четыре электрона валентной оболочки,
которые образуют четыре ковалентных связи с атомами водорода.
При формировании ковалентных связей электроны движутся между атомами и образуют области повышенной плотности электронной области,
называемые связующими парами электронов.
Из-за этого распределения электронов между атомами, в молекуле метана возникает электрический диполь.
На одной стороне молекулы, где находятся атомы водорода, электроны образуют область повышенной плотности,
что делает эту сторону молекулы частично отрицательно заряженной.
А на другой стороне молекулы, где находится атом углерода, электроны образуют область с пониженной плотностью,
что делает эту сторону молекулы частично положительно заряженной.
Такое распределение зарядов приводит к тому, что молекула метана имеет тетраэдрическую структуру.
Четыре атома водорода, замещены на гранях тетраэдра вокруг атома углерода.
Такая форма молекулы обеспечивает наименьшее взаимодействие между зарядами и достигает максимальной стабильности.
Электронные облака и их реакция

Форма молекулы метана определяется расположением электронных облаков вокруг атомов углерода и водорода. В молекуле метана (CH4) углеродный атом находится в центре и связан с четырьмя атомами водорода.
Атом углерода имеет четыре валентные электронные оболочки. Валентная электронная оболочка атома – это его наружная оболочка, которая содержит электроны, не участвующие в образовании внутренних химических связей атома. Углеродный атом имеет две электронные оболочки: внутреннюю, содержащую два электрона, и внешнюю, содержащую шесть электронов.
В молекуле метана четыре электрона на внешней оболочке углеродного атома осуществляют химическую связь с электронами валентных оболочек водородных атомов. В результате образуется вокруг углерода тетраэдрическая форма, где четыре атома водорода размещаются по вершинам треугольной пирамиды, стороны которой равны.
Такая конфигурация электронных облаков обусловлена стремлением системы уровней энергии к минимуму. В процессе образования молекулы метана, электроны между атомами перераспределяются таким образом, чтобы достигнуть наиболее стабильной энергетической конфигурации.
Тетраэдрическая форма молекулы метана является одной из стабильных конфигураций для углеродных соединений и обуславливает их химические свойства и реакционную способность.
Стабильность и энергия молекулы

Основная причина тетраэдрической формы молекулы метана связана со стабильностью и энергией системы. При таком расположении атомов водорода между ними возникают симметричные отталкивающие силы, которые препятствуют изменению углов связей. Такая конфигурация обеспечивает наиболее энергетически выгодное положение атомов и обладает минимальной энергией.
Другие конфигурации молекулы метана, например плоская или октаэдрическая, обладают более высокой энергией и менее стабильны. В тетраэдрической форме молекулы метана атомы находятся в равновесии, так как отталкивающие силы на всех связях равны. Это обеспечивает стабильность молекулы и способствует ее долгому существованию.
| Форма молекулы | Энергия молекулы | Стабильность молекулы |
|---|---|---|
| Тетраэдрическая | Минимальная | Максимальная |
| Плоская | Высокая | Низкая |
| Октаэдрическая | Высокая | Низкая |
Таким образом, тетраэдрическая форма молекулы метана обеспечивает наиболее стабильную конфигурацию и минимальную энергию системы. Именно благодаря этой конфигурации молекулы метана обладает высокой устойчивостью и является одним из самых распространенных углеводородов в природе.