Загадка благородных газов
Благородные газы - это особая группа элементов, к которой относятся гелий, неон, аргон, криптон, ксенон и радон. Их считают самыми неподвижными и инертными веществами в таблице Менделеева. Они остаются практически неприкасаемыми и необразуют химические соединения с другими элементами. Эта особенность благородных газов является одной из самых интригующих загадок для ученых.
Строение и особенности атомов благородных газов
Чтобы понять, почему благородные газы не образуют соединений, важно рассмотреть их атомную структуру. Атомы благородных газов имеют полностью заполненные электронные оболочки, которые состоят из 2 или 8 электронов. Это делает их стабильными и малоактивными в химических реакциях.
Отсутствие "желания" вступать в соединения
Электроны во внешней оболочке атома благородного газа находятся в очень высокоэнергетическом состоянии, что делает их очень устойчивыми. Благодаря этим электронам, атомы благородных газов обладают отрицательным зарядом, но они не проявляют "желания" вступать в химические соединения и обмениваться электронами с другими атомами. Вместо этого, они стремятся сохранить свою стабильность и неподвижность, что объясняет их низкую реактивность и способность существовать в природе как отдельные элементы.
Зачем благородным газам образовывать соединения?

Благородные газы (группа химических элементов, включающая в себя гелий, неон, аргон, криптон, ксенон и радон) обладают особенными характеристиками, которые делают их очень неподходящими для образования соединений.
| Химический элемент | Основные характеристики |
|---|---|
| Гелий | Имеет очень низкую электроотрицательность, что делает его неполярным и малоактивным химическим элементом. |
| Неон | Неон также обладает низкой электроотрицательностью и возможностью образовывать лишь небольшое количество химических соединений. |
| Аргон | Аргон является наиболее известным благородным газом и практически не образует химических соединений из-за его высокой атомной стабильности. |
| Криптон | Криптон обладает теми же характеристиками, что и аргон, и образование соединений ему также не выгодно. |
| Ксенон | Ксенон способен образовать некоторые химические соединения, однако он все равно относится к благородным газам, так как его потенциал образования соединений ограничен. |
| Радон | Радон является нестабильным и радиоактивным элементом, что делает его очень неподходящим для образования стабильных химических соединений. |
Несмотря на то, что благородные газы образуют очень ограниченное количество соединений, существуют некоторые важные причины, почему исследование и образование соединений с этими элементами имеют значение.
Во-первых, многие благородные газы являются важными инертными газами, необходимыми для поддержания определенных условий в различных технологических процессах и научных исследованиях. Например, аргон используется в сварке и технологии производства полупроводниковых приборов, а гелий применяется в аэростатике и медицинских процедурах.
Во-вторых, изучение возможностей образования соединений с благородными газами может привести к разработке новых материалов и технологий. Например, добавление аргона в стекло может сделать его более прозрачным и прочным, а создание новых соединений с ксеноном может привести к разработке новых видов флуоресцентных осветительных приборов.
Наконец, исследование благородных газов и их соединений позволяет углубить наше понимание основных законов химии и физики. Взаимодействие атомов и молекул благородных газов с другими элементами может расширить наши знания о взаимодействии веществ и способствовать развитию научных открытий и технологического прогресса.
Уникальные свойства благородных газов

Одно из наиболее удивительных свойств благородных газов заключается в их высокой инертности. Этот фундаментальный аспект благородных газов определяет их неспособность к образованию соединений с другими элементами. Инертность благородных газов объясняется полностью заполненным электронным уровнем внешней оболочки атомов этих элементов.
Как известно, атомы стремятся достичь электронной конфигурации, аналогичной электронной конфигурации благородных газов, так как она является наиболее устойчивой. Благодаря своей уникальной конфигурации электронов, благородные газы не образуют химические соединения с другими элементами. Это способствует их стабильности и инертности.
Кроме того, благородные газы обладают высокой степенью стабильности и низкой реакционной активностью. Они обычно не реагируют с другими элементами или соединениями, кроме экстремальных условий. Возможность благородных газов быть использованными в различных отраслях науки и технологии обусловлена их низкой реакционной активностью и отсутствием химической активности.
Благородные газы также используются в различных промышленных и научных процессах благодаря своим уникальным физическим и химическим свойствам. Например, гелий широко используется в аэростатике, благодаря своей низкой плотности, неподвижным свойствам и отсутствию агрессивности. Аргон и ксенон используются в электротехнике и осветительных приборах, как заполнители газовых разрядных ламп.
Все эти уникальные свойства благородных газов делают их важными для множества научных и технических приложений. Они продолжают быть объектом изучения исследователей в поиске новых способов использования их особых свойств для различных целей.
Почему благородные газы столь устойчивы?

Устойчивость благородных газов обусловлена их электронной конфигурацией. Внешний электронный слой благородных газов содержит полное количество электронов, что делает их энергетически стабильными. В результате этого, благородные газы не образуют химические соединения и редко вступают в реакции с другими элементами.
Кроме того, благородные газы обладают низкой электроотрицательностью, что означает, что они имеют малую склонность принимать или отдавать электроны. Это также способствует их устойчивости и низкой реактивности.
Благодаря своей устойчивости, благородные газы находят широкое применение в различных областях науки и промышленности. Например, гелий используется в аэростатике и в качестве охлаждающего агента в магнитно-резонансной томографии, аргона используется в сварке и среде для роста кристаллов, и ксенон применяется в осветительной технике и электрических лампах.
Энергетическая нецелесообразность образования соединений
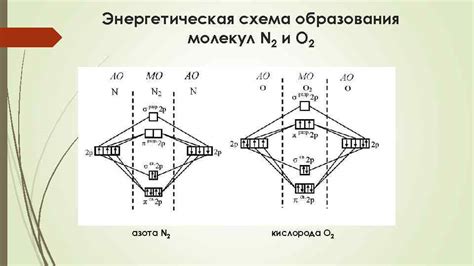
Для того чтобы образовать химическую связь между атомами, необходимо преодолеть энергетической барьер, известный как энергия активации. Чем выше энергия активации, тем сложнее происходит реакция. В случае благородных газов, энергия активации для образования химических соединений значительно выше, чем энергия, высвобождающаяся при образовании этих соединений.
Благородные газы имеют полностью заполненные внешние электронные оболочки, что делает их электронно стабильными. В результате, эти элементы обладают очень низкими значениями энергии ионизации и электроотрицательности, и, следовательно, практически не образуют ионы или связываются с другими атомами.
Энергетическая нецелесообразность образования соединений благородных газов также объясняется их объемом и размерами атомов. Атомы благородных газов являются маленькими и компактными, что позволяет им заполнять большие объемы и не смешиваться с другими атомами в реакционной среде.
Таким образом, энергетическая нецелесообразность образования соединений является основной причиной низкой реактивности благородных газов. Эти элементы остаются стабильными и не образуют химических связей с другими элементами, что делает их полезными в различных областях, таких как управление инертной атмосферой или наполнение световых приборов.
Электронная конфигурация и реакционная способность благородных газов
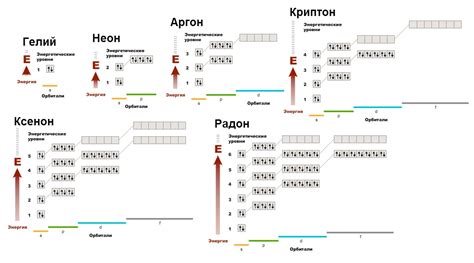
Благородные газы, такие как гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn), обладают особой химической инертностью и не образуют соединений с другими элементами. Это связано с их электронной конфигурацией и структурой электронных оболочек.
У каждого благородного газа внешний энергетический уровень полностью заполнен электронами. Например, у гелия есть два электрона на своей внешней оболочке, а у неона - восемь. Это полное окружение электронами делает эти элементы электронно стабильными.
Все благородные газы принадлежат к группе 18 (VIII группе) периодической системы элементов, называемой группой нобелевых газов. Эта группа также известна как группа инертных газов из-за их низкой реакционной способности. Реакционная способность элементов в значительной степени зависит от их электронной конфигурации и наличия свободных электронов на внешнем энергетическом уровне.
У благородных газов, таких как гелий и неон, нет свободных электронов на своей внешней оболочке, что делает их неспособными к образованию химических связей с другими элементами. Захват и передача электронов в реакциях все еще являются важными факторами, определяющими соединительную способность элементов. Однако благородные газы не могут образовывать соединения, потому что их электронная конфигурация полностью заполнена, и нет возможности для образования стабильных соединений с другими элементами.
Электронная конфигурация благородных газов делает их стабильными и неактивными в большинстве химических реакций. Они редко участвуют в химических реакциях и не образуют соединений с другими элементами при нормальных условиях. Их реакционная способность настолько низкая, что они называются "недоступными" или "неактивными" элементами.
Благородные газы находят широкое применение в различных областях, в том числе в исследованиях, экспериментах, современных технологиях и промышленности. Например, гелий используется в аэростатике и в заполнении шаров, неон применяется в рекламных вывесках и источниках света, аргон используется в сварке и плазменных антеннах, а ксенон применяется в лампах и источниках света высокой интенсивности.
Применение благородных газов без образования соединений

Благородные газы, такие как гелий, неон, аргон, криптон и ксенон, отличаются своей химической инертностью, что означает, что они не образуют легко соединений с другими элементами. Это свойство делает их полезными во многих приложениях.
Одним из ключевых применений благородных газов без образования соединений является их использование в осветительных приборах, таких как неоновые лампы. Когда электрический ток проходит через газ, он возбуждает атомы, стимулируя их энергетические уровни. При обратном переходе атомы испускают энергию в виде света определенной длины волны, что создает яркий и характерный цвет.
Благородные газы также широко применяются в индустрии для создания защитной атмосферы в процессах, требующих исключительной чистоты. Аргон, например, используется в процессе сварки, чтобы предотвратить окисление металла воздухом. Это позволяет получать более прочные и качественные сварные соединения.
| Газ | Применение |
|---|---|
| Гелий | Воздушные шары, охлаждение, научные исследования |
| Неон | Рекламные вывески, осветительные приборы |
| Аргон | Сварка, газовые лазеры, защита металлов |
| Криптон | Импульсные источники света, лазеры, яркие фонари |
| Ксенон | Медицинская анестезия, осветительные системы, автофары |



