Физические свойства газов и жидкостей во многом определяют их способность к сжатию. Изучение этого явления имеет огромное значение для науки и промышленности, поскольку позволяет понять причины и механизмы, лежащие в основе различных процессов: от хранения и транспортировки веществ до функционирования различных систем и агрегатов.
Одним из ключевых факторов, определяющих возможность сжатия газа, является его молекулярная структура и особенности взаимодействия между молекулами. В газе молекулы находятся на большом расстоянии друг от друга и движутся в свободном состоянии, испытывая лишь слабые притяжения или отталкивания. Это позволяет газу занимать значительный объем и легко подвергаться сжатию при воздействии внешних сил.
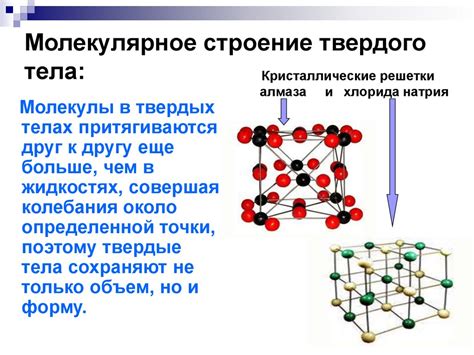
С другой стороны, жидкости обладают уже большей плотностью, поскольку их молекулы находятся ближе друг к другу и существуют сильные взаимодействия в виде взаимного притяжения. Это приводит к некоторому ограничению возможности сжатия жидкостей, так как их молекулы значительно труднее вытягивать и раздвигать друг от друга. Однако, несмотря на это, жидкости все же могут подвергаться некоторому сжатию при очень высоких давлениях или низких температурах.
Молекулярная структура газов
Газы состоят из свободно движущихся молекул, которые занимают большое пространство в сравнении с их собственным размером. Между молекулами газов существуют слабые межмолекулярные силы, такие как ван-дер-ваальсовы силы или дипольные взаимодействия.
Эту относительную слабость притяжения между молекулами газов можно сравнить с пружиной, которая легко сжимается и расширяется. Поэтому газы отличаются высокой сжимаемостью - их объём можно существенно изменять без изменения давления.
Из-за отсутствия закрепления молекул газы могут заполнять любое доступное пространство, распространяясь равномерно во всех направлениях. Они обладают молекулярной диффузией и эффузией - способностью распространяться через узкие отверстия.
Молекулярная структура газов также объясняет их способность расширяться при нагревании. При повышении температуры, энергия молекул газа увеличивается, что приводит к увеличению их средней кинетической энергии. Молекулы начинают быстрее двигаться и сталкиваться друг с другом, в результате чего объём газа увеличивается.
Все эти особенности молекулярной структуры газов позволяют им обладать такими свойствами, как высокая сжимаемость и возможность заполнять доступное пространство. Эти особенности являются фундаментальными в понимании поведения газов и их роли в природных и технических процессах.
Интермолекулярные силы в газообразных веществах
Основными типами интермолекулярных сил в газообразных веществах являются:
| Тип интермолекулярной силы | Описание |
|---|---|
| Дисперсионные силы | Силы, возникающие в результате временного неравномерного распределения электронов в молекулах. Они являются самыми слабыми типами интермолекулярных сил. |
| Дипольно-дипольные силы | Силы, возникающие в молекулах, обладающих постоянным электрическим диполем. Они возникают из-за разности зарядов в молекуле. |
| Водородные связи | Особый вид дипольно-дипольных сил, возникающих между молекулами, содержащими атомы водорода, связанные с атомами кислорода, азота или фтора. |
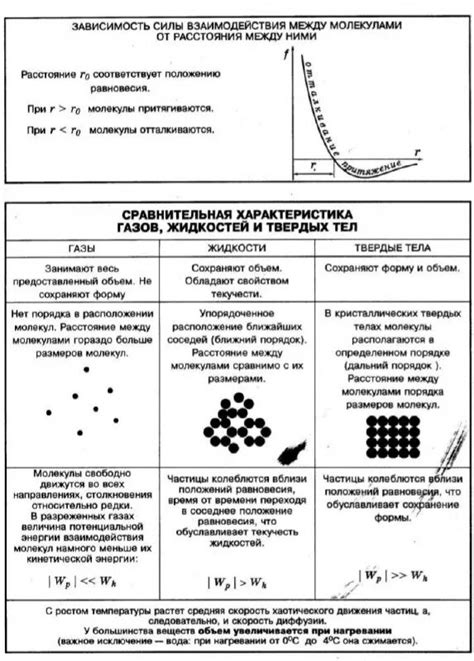
Эти интермолекулярные силы определяют степень силы притяжения между молекулами газообразных веществ. В газах молекулы находятся на достаточно больших расстояниях друг от друга, поэтому силы притяжения в таких веществах очень слабы. Это позволяет газам легко сжиматься при изменении давления или объема.
В то же время, в жидкостях интермолекулярные силы уже более сильны, так как молекулы находятся ближе друг к другу и испытывают взаимное притяжение. Это делает жидкости менее сжимаемыми, чем газы.
Таким образом, различие в силе интермолекулярных сил является основной причиной, почему газы легче сжимаются, чем жидкости.
Температура и давление влияют на сжимаемость газов
Газы обладают высокой степенью сжимаемости по сравнению с жидкостями. Это обусловлено несколькими причинами, включая температуру и давление.
Температура играет важную роль в сжимаемости газов. При повышении температуры молекулы газа начинают двигаться быстрее и занимать больший объем. Это означает, что газ становится менее плотным и более сжимаемым. Снижение температуры, напротив, приводит к замедлению движения молекул и увеличению плотности газа, что делает его менее сжимаемым.
Давление также влияет на сжимаемость газов. При увеличении давления газ сжимается и занимает меньший объем. Это происходит потому, что давление действует на молекулы газа, заставляя их сближаться и занимать более плотное пространство. Снижение давления, наоборот, позволяет газу расширяться и занимать больший объем, делая его более сжимаемым.
Комбинация температуры и давления оказывает сильное влияние на сжимаемость газов. При низких температурах и высоких давлениях газы становятся очень плотными и трудносжимаемыми. При высоких температурах и низких давлениях, наоборот, газы становятся менее плотными и более сжимаемыми.
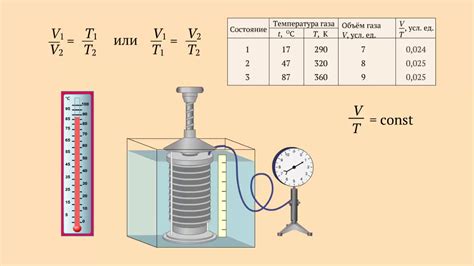
Закон Бойля-Мариотта и его влияние на сжимаемость газов

Согласно закону Бойля-Мариотта, при повышении давления на газ его объем сокращается, а при снижении давления - увеличивается. Это означает, что газы легче сжимать по сравнению с жидкостями.
Это происходит из-за особенностей строения и движения молекул в газовой среде. Молекулы газов находятся в состоянии более хаотичного движения и имеют большую свободу перемещения по сравнению с молекулами жидкостей. Благодаря этой свободе перемещения, молекулы газов имеют возможность заполнять все имеющееся пространство в контейнере, принимая его форму.
Сжатие газов возможно благодаря изменению объема пространства, в котором они содержатся. Вследствие этого, молекулы газов сталкиваются друг с другом и со стенками контейнера, вызывая повышенное давление. Как только давление увеличивается, объем газа сокращается, но молекулы газа по-прежнему свободно двигаются внутри этого сокращенного объема.
Этот принцип используется во многих областях промышленности и науки, таких как химическая промышленность, металлургия и воздухоплавание. Закон Бойля-Мариотта играет важную роль в понимании и применении принципов сжатия газов и контроля их объема.