Вы когда-нибудь задумывались, почему газы легко сжимаются, в отличие от других веществ? Если да, то сегодня мы разберемся в этом вопросе. Газы - это состояние вещества, которое отличается от твердого и жидкого состояний. Они обладают таким свойством, как высокая подвижность и способность к сжатию.
Причина легкого сжатия газа заключается в особенностях его молекулярной структуры. Молекулы газа находятся в постоянном состоянии движения и разлетаются во всех направлениях. Между молекулами газа существуют слабые притяжения, называемые межмолекулярными силами, которые не позволяют газу разлететься в разные стороны.
Когда мы пытаемся сжать газ, мы приложим давление на его объем. Это приводит к уменьшению расстояния между молекулами газа. При этом сжатие обусловлено взаимодействием между молекулами газа и дополнительными силами, которые воздействуют на них. Таким образом, газ легко сжимается, поскольку его молекулы находятся на значительном расстоянии друг от друга и не имеют устойчивого порядка.
Молекулярное движение и свойства газов
Газы состоят из микроскопических частиц, называемых молекулами. Молекулы газов непрерывно двигаются с высокой скоростью, сталкиваясь друг с другом и с более крупными объектами в своем окружении.
Молекулярное движение является причиной основных свойств газов. Во-первых, газы легко сжимаются. Это связано с тем, что между молекулами газа существует большое количество пустого пространства. При сжатии газа молекулы просто сближаются друг с другом, заполняя это пространство. Благодаря своему молекулярному движению, газы могут изменять свою объемную форму с минимальными усилиями.
Кроме того, свободное движение молекул газов позволяет им заполнять все доступные им пространства. Это объясняет свойство газов расширяться и занимать весь объем, содержащий их, пока они не встретят преграду.
- Молекулярное движение также обуславливает свойство газов распространяться по всем доступным направлениям с одинаковой скоростью. Если газ находится в закрытом сосуде, молекулы его создают давление на стенки сосуда, что объясняет явление атмосферного давления.
- Молекулярное движение также является причиной теплопроводности газов. Когда горячий газ находится рядом с холодным объектом, энергия молекул горячего газа передается молекулам холодного объекта за счет их столкновений, что приводит к нагреванию холодного объекта.
Таким образом, молекулярное движение играет ключевую роль в понимании свойств газов, таких как легкость сжатия, расширяемость, рост давления и теплопроводность.
Основные причины легкой сжимаемости газов
Основные причины легкой сжимаемости газов связаны с двумя факторами: свойствами молекул газа и межмолекулярными силами.
Во-первых, молекулы газа находятся на большом расстоянии друг от друга и движутся хаотически. У них есть большое пространство для движения и они не оказывают сильное влияние друг на друга. Когда газ сжимается, молекулы сближаются, но они все еще имеют свободное пространство для движения. Это позволяет газу легко сжиматься.
Во-вторых, межмолекулярные силы в газах слабые. Это означает, что эти силы не создают достаточного сопротивления для сжатия газа. В отличие от твердых веществ, где сильные межатомные связи препятствуют сжатию, или жидкостей, где силы когезии держат молекулы близко друг к другу, газы имеют слабые силы взаимодействия, что позволяет им легко сжиматься.
Таким образом, основные причины легкой сжимаемости газов связаны с расстоянием и движением молекул газа, а также слабыми межмолекулярными силами. Эти свойства делают газы уникальными в отношении сжимаемости и позволяют им занимать минимальный объем при достаточно большом давлении.
Роль промежутков между молекулами
Одна из основных причин, по которой газы легко сжимаются, заключается в том, что у них есть значительные промежутки между молекулами. В отличие от твердых и жидких веществ, где молекулы находятся очень близко друг к другу, молекулы газов находятся на больших расстояниях друг от друга.
Эти промежутки между молекулами газов могут быть достаточно значительными по сравнению с сами молекулами. Из-за этого газы имеют высокую степень сжимаемости. При воздействии на газ давления или силы, молекулы могут легко перемещаться и сжиматься в пространстве между ними.
Когда газ сжимается, молекулы сближаются и занимают меньшее пространство, что приводит к увеличению плотности газа. При этом объем газа уменьшается, а давление внутри него повышается. Именно эта способность газов к сжимаемости делает их особенно полезными для множества промышленных и бытовых приложений, например, в работе автомобильных двигателей или компьютерных систем охлаждения.
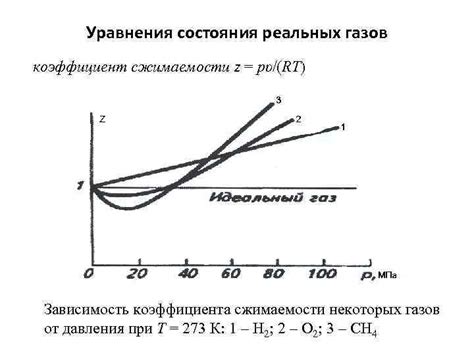
Зависимость сжимаемости от давления и температуры
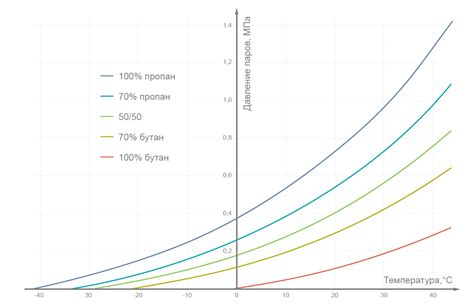
Газы легко сжимаются по сравнению с жидкостями и твердыми телами. Это связано с тем, что между молекулами газов существует большое количество свободного пространства, что позволяет им деформироваться и занимать новые объемы при изменении давления и температуры.
Сжимаемость газа зависит от двух факторов: давления и температуры. При увеличении давления на газ, его молекулы начинают сближаться, занимая меньший объем. Это явление называется компрессией. В результате компрессии газ становится более плотным и занимает меньший объем.
Температура также оказывает влияние на сжимаемость газа. При низкой температуре молекулы газа двигаются медленно и сильно притягиваются друг к другу. В результате газ становится более плотным и сжимаемым. При повышении температуры молекулы газа приобретают большую энергию и начинают двигаться быстрее, отталкиваясь друг от друга. Это приводит к увеличению объема газа и его уменьшению компрессией.
Для наглядного представления зависимости сжимаемости газа от давления и температуры, можно построить таблицу. В данной таблице представлены значения объема газа при разных давлениях и температурах. С увеличением давления и/или понижением температуры, объем газа уменьшается, что свидетельствует о его сжимаемости.
| Давление (атм) | Температура (°C) | Объем газа (литры) |
|---|---|---|
| 1 | 25 | 10 |
| 2 | 25 | 5 |
| 1 | 50 | 5 |
Таблица показывает, что при увеличении давления или понижении температуры, объем газа сокращается. Это явление наглядно демонстрирует, что газы легко сжимаются и могут менять свой объем в зависимости от внешних факторов.
Законы Бойля-Мариотта и Шарля

Существуют два важных закона, которые объясняют поведение газов при изменении давления и температуры. Эти законы называются законами Бойля-Мариотта и Шарля.
Закон Бойля-Мариотта гласит, что при неизменной температуре количество газа увеличивается с уменьшением его давления и наоборот. Другими словами, если мы сжимаем газ, его давление увеличивается, а если мы расширяем газ, его давление уменьшается. Это объясняет, почему газы легко сжимаются.
Закон Шарля, также известный как закон Гей-Люссака, определяет зависимость объема газа от температуры. При постоянном давлении объем газа увеличивается с увеличением температуры и уменьшается с уменьшением температуры. Это означает, что при нагревании газ расширяется, а при охлаждении сжимается.
Законы Бойля-Мариотта и Шарля являются основополагающими принципами газовой теории и позволяют нам понять, почему газы обладают свойствами сжимаемости и изменяемости объема при изменении давления и температуры. Эти законы помогают ученым и инженерам предсказывать и контролировать поведение газов в различных условиях.
Практическое применение свойств газов в жизни
Свойства газов, такие как сжимаемость и возможность расширяться, находят широкое применение в нашей повседневной жизни. Рассмотрим некоторые примеры:
| Пример | Описание |
|---|---|
| Автомобильные шины | Шины автомобилей заполняются воздухом или другим газом, чтобы обеспечить аккуратное сцепление с дорожным покрытием. Газ в шинах позволяет шинам сжиматься при нагрузке на автомобиль и возвращаться в исходное состояние, обеспечивая комфортное и безопасное вождение. |
| Баллончики с газом | Баллончики с газом, такие как спреи для краски или дезодоранты, используют сжатый газ внутри для создания давления, которое позволяет равномерно распылить содержимое при нажатии на кнопку. Благодаря этому свойству газов, мы можем легко наносить краску или использовать дезодоранты без необходимости использования подобного механизма. |
| Считывание давления | Врачи могут использовать аппараты для измерения давления, такие как тонометры, которые работают на основе принципов газов. Они используют давление газа внутри манжеты для определения давления крови пациента. |
| Газовые плиты | Газовые плиты работают на основе сжигания газа (обычно природного) с помощью форсунок. Газ сжимается и выходит из форсунки под высоким давлением, а когда он смешивается со свежим воздухом, происходит горение. Благодаря возможности регулирования подачи газа можно легко и точно контролировать температуру готовки. |
Это только несколько примеров, как свойства газов используются в нашей жизни. Хорошее понимание этих свойств помогает нам осознать, как газы влияют на наше окружение и как мы можем использовать их в повседневных ситуациях.