Газы - это состояние вещества, в котором молекулы перемещаются весьма болезненно и ориентируются друг относительно друга. Вместо того чтобы быть связанными в густом теле, газовые молекулы постоянно перемещаются и сталкиваются друг с другом, создавая высокую энергию и внося свою лепту в давление газа.
Одной из ключевых характеристик газов является то, что они полностью заполняют объем, в который они помещены. Это происходит из-за принципа равнораспределения молекул внутри газа. Все газовые молекулы постоянно двигаются в случайных направлениях, с различными скоростями и энергией.
Когда газ находится в закрытом объеме, молекулы сталкиваются со стенками и друг с другом. Эти столкновения создают давление, которое равномерно распределяется по всем сторонам объема, включая верхнюю, нижнюю, переднюю и заднюю стенки. Благодаря этому принципу равнораспределения молекул, газы могут наполнять любой доступный для них объем.
Этот принцип иллюстрирует, почему газы могут расширяться и сжиматься, а также почему они равномерно заполняют любые контейнеры, в которые они помещены. Важно отметить, что данный принцип идеально работает только в идеальных условиях, когда газы являются идеальными. В реальности возможны некоторые отклонения, но общий принцип остается верным для большинства газов.
Газы и принцип равнораспределения молекул
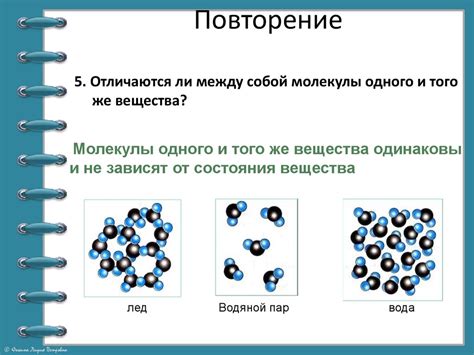
Согласно этому принципу, молекулы газа находятся в постоянном движении и сталкиваются друг с другом и со стенками сосуда. При каждом столкновении они меняют свое направление и скорость. В результате этого процесса молекулы перемешиваются внутри объема газа и распределяются равномерно.
Объяснение этого явления можно найти в кинетической теории газов. Согласно этой теории, газ состоит из огромного числа молекул, которые движутся в случайных направлениях и со случайными скоростями. Столкновения между молекулами и с другими объектами внутри газового объема приводят к перемешиванию и равномерному распределению молекул.
Принцип равнораспределения молекул помогает объяснить такие важные свойства газов, как их равномерное заполнение сосуда, возможность диффузии и распространения запахов, а также давление газа на стенки сосуда.
Особенности поведения газов

Поведение газов определяется принципом равнораспределения молекул, который подразумевает, что молекулы газа имеют свободную и хаотическую структуру и всегда находятся в постоянном движении.
Одной из особенностей поведения газов является их способность полностью заполнять доступный для них объем. Это происходит по причине непрерывного и хаотичного движения молекул, которые сталкиваются друг с другом и со стенками сосуда, в котором находятся.
Молекулы газа обладают некоторой энергией, которая вызывает их движение во всех направлениях. Когда молекулы сталкиваются с препятствиями, такими как стенки сосуда, они отскакивают от них, меняя направление движения. Благодаря этим столкновениям, газ распределяется равномерно по всему объему сосуда.
Принцип равнораспределения молекул также означает, что молекулы газа обладают различными скоростями. Некоторые молекулы движутся быстрее, другие медленнее, но в среднем скорость движения молекул одинакова. Это является основой для определения средней кинетической энергии молекул газа и его температуры.
Таким образом, особенностью поведения газов является их способность полностью заполнять доступный объем благодаря непрерывному хаотическому движению молекул и столкновениям между ними и со стенками сосуда.
Кинетическая теория и газы
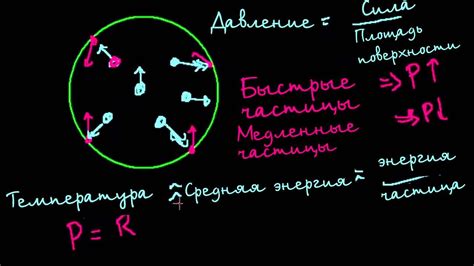
Согласно кинетической теории, газ состоит из молекул, которые находятся в непрерывном движении. Движение молекул газа является хаотичным, а их скорости постоянно изменяются. Молекулы сталкиваются друг с другом и со стенками сосуда, в котором находится газ.
В результате столкновений молекул газа с поверхностью сосуда или другими молекулами происходит обмен импульсом и энергией. Такое столкновение ведет к изменению скорости и направления движения молекулы, что создает в газе случайное хаотическое движение.
Важной особенностью кинетической теории является то, что молекулы газа считаются точечными и немассированными, то есть их размеры и взаимодействие между собой не учитываются. Это упрощение позволяет рассмотреть газ как набор индивидуальных молекул, каждая из которых движется независимо.
Принцип равнораспределения молекул гласит, что в равновесном газе молекулы равномерно заполняют доступный им объем. Это означает, что вероятность нахождения молекулы газа в любой точке этого объема равна для всех молекул.
Данный принцип объясняется статистическим распределением скоростей молекул в газе. По мере увеличения скоростей молекул, вероятность нахождения молекулы в данной точке объема уменьшается, но одновременно увеличивается плотность молекулы в другом месте.
Таким образом, принцип равнораспределения молекул является следствием статистического поведения молекул газа и основной причиной того, что газы полностью заполняют доступный им объем без оставления пустот.
Принцип равнораспределения молекул

Этот принцип основан на предположении о случайном и беспорядочном движении молекул газа. Молекулы постоянно движутся внутри газового объема со случайными скоростями и в разных направлениях. Благодаря этому случайному движению, молекулы газа равномерно распределяются внутри его объема.
Принцип равнораспределения молекул имеет особое значение для понимания макроскопических свойств газа. Поскольку молекулы газа равномерно распределены, это означает, что каждая часть объема газа содержит одинаковое количество молекул. Из этого следует, что давление газа равномерно распределено внутри его объема, что объясняет его равномерное проявление на стенках сосуда.
Также принцип равнораспределения молекул объясняет, почему газы полностью заполняют доступный им объем. Молекулы газа не имеют определенного объема и размера, поэтому они могут свободно перемещаться и заполнять весь объем сосуда, в котором они находятся.
Принцип равнораспределения молекул помогает объяснить такие явления, как диффузия и смешивание газов. Молекулы газа, двигаясь случайно и беспорядочно, могут перемешиваться с молекулами другого газа или распространяться внутри среды.
Таким образом, принцип равнораспределения молекул является фундаментальным понятием в кинетической теории газов, позволяющим объяснить макроскопические свойства газов на основе движения и взаимодействия их молекул.
Почему газы полностью заполняют объем

Это связано с особенностями строения молекул газа и их движением. Молекулы газов находятся в постоянном движении, перемещаются в случайном направлении и со случайной скоростью.
Принцип равнораспределения молекул гласит, что молекулы газа распределены равномерно по его объему. Это означает, что в любой точке газа примерно одинаковое количество молекул, независимо от их размера или типа.
Каждая молекула газа сталкивается с другими молекулами и со стенками сосуда, в котором она находится. Эти столкновения происходят случайным образом, а их количество и энергия зависят от температуры и давления газа.
Из-за большого количества молекул в газе, их случайного движения и постоянных столкновений, газ заполняет все доступное ему пространство. Это объясняет его способность полностью заполнять объем и проникать в каждый малейший уголок сосуда, в котором он находится.
Молекулярная структура газов делает их очень подвижными. Именно благодаря этой особенности газы используются в различных областях, таких как промышленность, наука и технологии. Они могут заполнять большие объемы, равномерно распределиться и смешиваться с другими газами или жидкостями.