Газы - это одно из трех основных состояний веществ, вместе с твердыми и жидкими. Они являются важной и неотъемлемой частью нашей жизни. Газы, в отличие от твердых и жидких веществ, не имеют определенной формы и объема. Вместо этого они заполняют все доступное им пространство.
Причина, по которой газы заполняют все пространство, связана с их молекулярной структурой и движением. Молекулы газа находятся в постоянном движении, перемещаясь во всех направлениях. Они сталкиваются друг с другом и со стенками сосуда, в котором находятся.
За счет этих столкновений газы заполняют все пространство, равномерно распределенные по объему сосуда. Каждая молекула газа имеет энергию, которая влияет на ее скорость движения. Высокая скорость молекул газа приводит к более частым столкновениям и большему давлению.
Интересно отметить, что газы могут сжаться или расшириться в зависимости от внешних условий. Увеличение давления или снижение температуры может привести к сжатию газа, а уменьшение давления или повышение температуры может вызвать его расширение.
Газы и их свойства

Причина, по которой газы заполняют все пространство, заключается в их молекулярной структуре. Молекулы газа находятся в движении и не имеют определенной формы или объема. Они перемещаются со случайной скоростью и сталкиваются друг с другом и со стенками сосуда, в котором находятся.
Свойства газов определяются температурой и давлением, под которыми они находятся. Известное свойство газов – их сжимаемость. Под действием давления газ может уменьшать свой объем, в то время как твердые тела и жидкости практически не сжимаемы. Это явление объясняется большим расстоянием между молекулами газа по сравнению с небольшим объемом, которым они занимают.
Важно отметить, что газы обладают низкой плотностью. Их масса на единицу объема гораздо меньше, чем у твердых тел или жидкостей. Именно поэтому газы так легко распространяются и заполняют все доступное пространство.
Другие свойства газов включают высокую подвижность (отсутствие взаимодействия между молекулами газа), возможность изменения объема под воздействием внешних факторов (давления и температуры), а также диффузию (перемешивание молекул разных газов между собой).
Определение газов
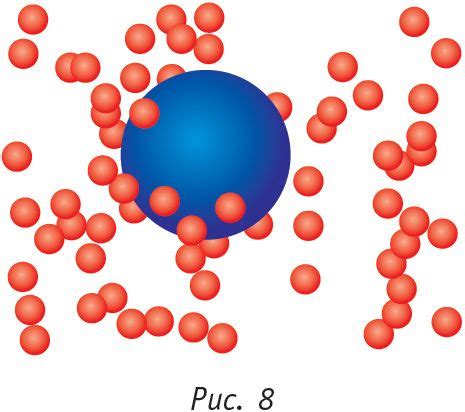
Газы состоят из отдельных молекул, которые находятся в постоянном движении. Частицы газа сталкиваются друг с другом и со стенками сосуда, в котором находятся. Удары молекул об стенки создают давление газа.
Одной из главных характеристик газов является их плотность. Плотность газа определяется количеством молекул в единице объема. Газы с большей плотностью содержат больше молекул на единицу объема и могут быть более тяжелыми.
Газы имеют ряд важных свойств, включая сжимаемость и расширяемость. Из-за того, что газы состоят из отдельных молекул, между которыми есть пустоты, они могут легко сжиматься и расширяться под воздействием давления и изменения температуры.
В промышленности газы используются в широком спектре приложений, таких как производство энергии, промышленные процессы и транспортировка. Также газы играют важную роль в атмосфере, поддерживая жизнь на Земле.
Кинетическая теория газов

Согласно кинетической теории газов, газовые молекулы находятся в постоянном хаотическом движении. Они непрерывно сталкиваются друг с другом и со стенками сосудов, в которых содержится газ. В результате таких столкновений молекулы меняют свое направление и скорость.
Кинетическая энергия газовых частиц пропорциональна их скорости. Из этого следует, что частицы с более высокой скоростью имеют большую кинетическую энергию. При повышении температуры газа средняя скорость частиц увеличивается, что приводит к увеличению давления газа.
Интересно отметить, что кинетическая энергия газовых частиц значительно превышает энергию притяжения между ними. В связи с этим газы имеют свойство расширяться и занимать всё доступное им пространство. Они равномерно заполняют все открытые сосуды без внешних воздействий.
Таким образом, кинетическая теория газов предоставляет нам понимание молекулярного уровня поведения газовых субстанций и помогает объяснить фундаментальные принципы их распределения в пространстве.
Движение молекул
Тепловое движение обусловлено термической энергией молекул газа. Молекулы обладают кинетической энергией, которая зависит от их скорости. В результате столкновений между молекулами происходит передача энергии, что приводит к изменению их скоростей и направлений движения. Под влиянием теплового движения молекулы распределяются равномерно по всему объему доступного пространства.
Движение молекул газа также обеспечивает его диффузию, то есть перемещение молекул из области более высокой концентрации в область более низкой концентрации. В результате диффузии газы равномерно смешиваются и заполняют все пространство.
Диффузия газов

При диффузии газы перемещаются из зоны повышенной концентрации в зону пониженной концентрации. Таким образом, газы заполняют все доступное пространство из-за их способности распространяться в объеме. Диффузия газов возникает из-за разницы в концентрациях газов в разных точках пространства и стремления системы достичь равновесия.
Основными факторами, влияющими на диффузию газов, являются разница в концентрации молекул, давление и температура. Чем больше разница в концентрации между двумя зонами, тем быстрее происходит диффузия. При повышении давления диффузия ускоряется, так как частицы газа имеют больше шансов столкнуться и перемешаться. Температура также влияет на диффузию, так как при повышении температуры частицы газа приобретают большую кинетическую энергию, что способствует более интенсивному перемешиванию.
Диффузия газов играет важную роль во многих процессах, включая дыхание, химические реакции, атмосферные явления и технические процессы. Понимание и изучение диффузии газов позволяет предсказать и контролировать множество физических и химических процессов, что имеет практическое значение в различных областях науки и техники.
Процесс диффузии

Диффузия – это процесс перемешивания частиц двух или более различных веществ в результате их случайного теплового движения. В газообразных средах наиболее характерен процесс диффузии газов.
Во время диффузии газы перемещаются от областей с более высокой концентрацией к областям с более низкой концентрацией. Этот процесс непрерывного перемешивания частиц газов осуществляется благодаря их случайным столкновениям.
Молекулы газов постоянно двигаются и сталкиваются друг с другом, и во время столкновений возникают изменения их кинетической энергии и направления движения. Благодаря этим случайным столкновениям молекул газов из области повышенной концентрации начинают переходить в области сниженной концентрации, и наоборот.
Процесс диффузии зависит от таких факторов, как разность концентраций, температура, давление и характер взаимодействия между молекулами газа. Молекулы газов могут двигаться через малые отверстия, проникать через пористые материалы или перемещаться по градиенту концентрации.
Таким образом, процесс диффузии является основным механизмом перемешивания газов в пространстве. Благодаря диффузии газы могут заполнять все доступное им пространство и равномерно распределяться в нем.
Законы заполнения пространства газами

Почему газы заполняют все пространство? Ответ на этот вопрос можно найти в законах заполнения газами, которые описывают их поведение при различных условиях.
Закон Бойля-Мариотта устанавливает прямую пропорциональность между давлением и объемом газа при постоянной температуре: чем выше давление, тем меньше объем. Этот закон объясняет, почему газы расширяются, когда их давление увеличивается.
Закон Шарля говорит о том, что объем газа прямо пропорционален его температуре при постоянном давлении. С увеличением температуры газы расширяются и занимают больший объем.
Закон Гей-Люссака устанавливает обратную пропорциональность между объемом газа и его температурой при постоянном давлении. При повышении температуры газы занимают меньший объем.
Эти законы позволяют нам понять, что газы имеют свойство заполнять все им доступное пространство. Сочетание физических законов обусловливает поведение газов и объясняет, почему они равномерно рассеиваются во всей среде.



