Сжатие газов и негибкость жидкостей - фундаментальные свойства, лежащие в основе многих процессов в природе и технике. Но почему это происходит и в чем заключается разница между сжатием газов и жидкостей?
У газов молекулы настолько удалены друг от друга, что между ними преобладает взаимное притяжение. Из-за этого газы могут легко сжиматься при действии внешнего давления. Они изменяют свой объем и форму, заполняя полностью имеющееся пространство. И если перестать действовать на газ внешним давлением, он вновь распространится во все стороны.
В случае с жидкостями ситуация сложнее: они способны несжимаемости и принимают форму емкости, в которой находятся. Жидкости обладают свободным поверхностным слоем, который определяет их форму. Это происходит из-за того, что в жидкостях между молекулами существует сильное взаимодействие, что делает их менее подвижными в сравнении с газами.
Кроме того, газы и жидкости отличаются и другими свойствами. Газы обычно имеют низкую плотность и высокую подвижность, благодаря чему они легко распространяются по сосуду или пространству. Жидкости же обладают большей плотностью и сравнительно низкой подвижностью. Они могут быть переливаемыми, но не могут заполнять полностью имеющееся пространство, как газы.
Причины сжатия газов и несжимаемости жидкостей

Газы представляют собой вещества, в которых молекулы находятся на большом расстоянии друг от друга и могут перемещаться в пространстве свободно. При увеличении давления на газ, молекулы сближаются и межмолекулярные силы становятся сильнее. Это приводит к уменьшению объема газа и его сжатию. Физические законы, такие как закон Бойля-Мариотта и закон Шарля, описывают зависимость объема газа от давления и температуры.
В отличие от газов, жидкости имеют более плотную структуру и молекулы находятся ближе друг к другу. В результате этого жидкости имеют малую сжимаемость и сохраняют свою форму при изменении давления. Внутренние силы, действующие между молекулами жидкости, сопротивляются изменению объема и сохраняют его практически постоянным.
Однако, в определенных условиях, жидкости могут быть сжаты и изменить свой объем. Это происходит при очень высоких давлениях или низких температурах, когда силы притяжения между молекулами становятся сильнее и возникает необходимость в учете сжимаемости жидкости.
Влияние межмолекулярного пространства

Межмолекулярное пространство представляет собой расстояние между молекулами вещества. В газообразном состоянии межмолекулярное пространство велико, и молекулы находятся на значительном расстоянии друг от друга. Из-за этого газы обладают высокой подвижностью и могут легко сжиматься под действием давления.
С другой стороны, в жидкостях межмолекулярное пространство меньше, и молекулы находятся ближе друг к другу. Жидкости обладают большей плотностью по сравнению с газами и имеют жесткую форму, принимая форму сосуда, в котором они находятся. Такое расположение молекул в жидкости препятствует их сжатию, поэтому жидкости практически не сжимаются под действием давления.
Межмолекулярное пространство вещества оказывает влияние не только на возможность сжатия вещества, но и на его физические свойства. Например, вода, благодаря своей молекулярной структуре и межмолекулярным взаимодействиям, обладает высокой плотностью, что делает ее особо полезной во многих сферах деятельности человека.
| Свойства газов | Свойства жидкостей |
|---|---|
| Высокая подвижность | Меньшая подвижность |
| Возможность сжатия под действием давления | Практически невозможность сжатия под действием давления |
| Молекулы находятся на значительном расстоянии друг от друга | Молекулы находятся ближе друг к другу |
Взаимодействие молекул вещества
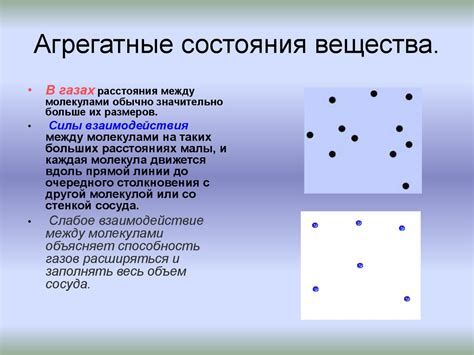
Молекулы газов находятся в постоянном хаотическом движении и сталкиваются друг с другом. При увеличении давления на газ, расстояние между молекулами уменьшается, и возникают силы аттракции между ними. Эти силы препятствуют увеличению объема газа и поддерживают его сжатое состояние.
В жидкостях молекулы также находятся в постоянном движении, но они настолько близко расположены друг к другу, что взаимодействие между ними значительно усиливается. Молекулы жидкости образуют сильные взаимные притяжения и образуют своеобразные структуры – жидкостные кластеры. Это позволяет жидкости сохранять свою форму и объем даже при давлении, отличном от атмосферного.
Таблица ниже демонстрирует различия взаимодействия молекул вещества:
| Состояние вещества | Взаимодействие молекул |
|---|---|
| Газ | Нет сильных притяжений. Молекулы находятся на большом расстоянии друг от друга. |
| Жидкость | Есть сильные притяжения между молекулами. Молекулы находятся близко друг к другу, образуя жидкостные кластеры. |
Структурные различия газов и жидкостей
Газы и жидкости отличаются своей структурой и взаимодействием частиц, что приводит к различным свойствам этих веществ. Рассмотрим основные структурные различия между газами и жидкостями:
- Газы представляют собой вещества, частицы которых находятся в хаотичном движении и занимают большой объем. В отличие от газов, жидкости имеют определенный объем и форму, так как частицы жидкости тесно упакованы и взаимодействуют между собой.
- В газах между частицами существуют слабые силы взаимодействия, что позволяет им свободно перемещаться и заполнять любую емкость. В жидкостях силы взаимодействия частиц более сильны, что приводит к их тесной упаковке и сохранению формы.
- Газы обладают высокой подвижностью и могут расширяться или сжиматься под действием давления и изменения температуры. Жидкости имеют меньшую подвижность и сжимаемость, так как в них установилось равновесие между силами взаимодействия частиц.
- В газах частицы имеют большое среднее расстояние между собой, а в жидкостях это расстояние значительно меньше. Это объясняет высокую плотность и вязкость жидкостей по сравнению с газами.
- Газы легко смешиваются друг с другом, образуя равномерную смесь. Жидкости смешиваются значительно медленнее и могут образовывать двухфазные системы.
В результате этих структурных различий газы сжимаются легко, а жидкости обладают меньшей сжимаемостью.
Влияние температуры на сжимаемость

Напротив, жидкости характеризуются низкой сжимаемостью за счет более плотной упаковки частиц и меньшей свободы их движения. При повышении температуры этих веществ, движение и коллизии между частицами увеличиваются незначительно, поэтому давление и объем жидкости практически не изменяются. Таким образом, жидкости обладают малой сжимаемостью.
Важно отметить, что существуют некоторые исключения, например, вода при температуре около 4°C имеет максимальную плотность и может быть сжата при изменении температуры. Однако, в целом, большинство жидкостей сохраняют свои объемы при изменении температуры.
Давление и сжимаемость вещества

Газы обладают высокой степенью сжимаемости. Это означает, что они могут легко сжиматься под действием внешнего давления. При увеличении давления на газ его объем уменьшается, а его плотность возрастает. Это связано с тем, что межмолекулярные силы в газе относительно слабы, и молекулы свободно движутся, не имея постоянной структуры.
В свою очередь, жидкости обладают низкой степенью сжимаемости. Они могут сжиматься, но этот процесс требует значительного давления. При увеличении давления на жидкость ее объем изменяется незначительно, а плотность остается примерно постоянной. Это связано с тем, что межмолекулярные силы в жидкости сильнее, и молекулы находятся друг близ друга, образуя постоянную структуру.
Таким образом, различия в сжимаемости газов и жидкостей обусловлены различием в их молекулярной структуре и силе взаимодействия между молекулами. Эти свойства определяют поведение вещества под воздействием давления и являются важными для понимания его физических свойств и процессов.
Закон сохранения объема в жидкостях и газах

В физике существует основной принцип, называемый законом сохранения объема, который указывает на то, что объем жидкостей и газов остается постоянным при изменении давления или температуры. Этот закон важен для понимания поведения и свойств жидкостей и газов.
В отличие от газов, жидкости несжимаемы. Это означает, что объем жидкости остается неизменным при любом изменении давления или температуры. Например, если мы поместим жидкость в закрытый сосуд и будем увеличивать давление, объем жидкости останется постоянным. Также, если мы изменяем температуру жидкости, ее объем не будет меняться.
Наоборот, газы сжимаемы. При увеличении давления на газ, его объем сокращается. То же самое происходит и при изменении температуры газа. Например, если мы поместим газ в закрытый сосуд и будем увеличивать давление, его объем будет уменьшаться. Также, если мы изменяем температуру газа, его объем также будет изменяться.
Закон сохранения объема важен для решения множества задач в физике и химии, связанных с изучением свойств жидкостей и газов. Он позволяет предсказывать, как изменится объем вещества при различных условиях. Этот закон играет ключевую роль в различных научных и технических областях, таких как строительство, машиностроение и химическая промышленность.