Глюкоза - широкоизвестное вещество, обладающее рядом уникальных свойств. Одно из таких свойств - его хорошая растворимость в воде. Это является важным фактором в биологических процессах и обуславливает множество его полезных свойств. Но почему глюкоза так хорошо растворяется в воде? Давайте попробуем разобраться в этом вместе.
Во-первых, следует отметить, что структура глюкозы играет значительную роль в его растворимости. Глюкоза - простой сахар, молекула которого состоит из шести атомов углерода, двенадцати атомов водорода и шести атомов кислорода. Ее также можно найти в больших количествах в природе, например, в плодах и ягодах различных растений. Благодаря такой структуре глюкозы, она способна образовывать водородные связи с молекулами воды, что способствует ее растворению в воде.
Кроме того, глюкоза обладает поларной структурой, что также способствует его растворимости в воде. Молекула глюкозы имеет заряды, так называемые положительные и отрицательные концы, которые подвержены электростатическому взаимодействию с зарядами молекулы воды. Это так называемая гидратация глюкозы, при которой молекулы воды образуют гидратную оболочку вокруг глюкозы и помогают ей раствориться.
Глюкоза: структура и свойства
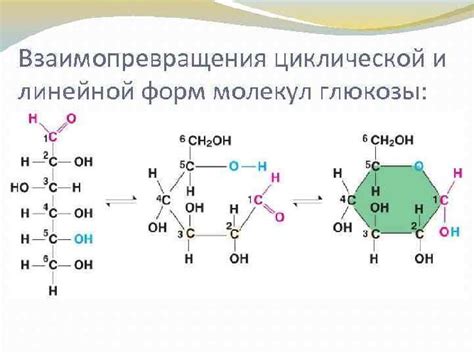
Структурная формула глюкозы представляет собой кольцевую структуру, состоящую из шестиугольного кольца. Кольцевая форма образуется при взаимодействии гидроксильной группы (-OH) на пятом атоме углерода с одной из гидроксильных групп на первом или четвёртом атоме.
Одним из замечательных свойств глюкозы является её высокая растворимость в воде. Это происходит из-за наличия гидроксильных групп (-OH) в структуре глюкозы, которые образуют водородные связи с молекулами воды. Благодаря этому, глюкоза улучшает гидратацию молекул воды и образует стабильные растворы с различной концентрацией.
Кроме того, глюкоза является ключевым источником энергии для организма. Она участвует в метаболических процессах, обеспечивая клеткам энергией для жизнедеятельности. Глюкоза также является строительным материалом для костей, хрящей и других тканей организма.
Благодаря своей уникальной структуре и свойствам, глюкоза играет важную роль в множестве жизненно важных процессов и находит применение в различных отраслях науки и медицины.
Гидратация глюкозы
В процессе гидратации глюкозы положительно заряженные кислородные атомы входят во взаимодействие с отрицательно заряженными атомами воды, а отрицательно заряженные атомы углерода глюкозы – с положительно заряженными атомами воды. Такое взаимодействие, основанное на силе притяжения зарядов разного знака, позволяет образовывать стабильные связи между глюкозой и водой.
Гидратация глюкозы является важным физико-химическим процессом, поскольку водное растворение глюкозы способствует ее транспортировке и метаболическим реакциям в организме. Благодаря способности глюкозы образовывать стабильные водные растворы, она может быстро и легко распространяться по тканям и органам и участвовать во многих биологических процессах.
Вода является одним из наиболее распространенных растворителей в природе, и многие вещества, включая глюкозу, хорошо растворяются в ней. Гидратация глюкозы обусловлена не только ее структурой, но и свойствами воды как растворителя. Вода обладает положительно и отрицательно заряженными частичками, что облегчает взаимодействие со многими молекулами, включая глюкозу. Благодаря этим свойствам вода способна стабилизировать молекулы глюкозы в растворе и обеспечивать физиологическую активность этого углеводорода.
Полярность глюкозы и воды

Глюкоза - это моносахарид, состоящий из шести атомов углерода, двенадцати атомов водорода и шести атомов кислорода. У этого соединения имеется гидроксильная группа (-OH) при каждом атоме углерода, кроме одного из них. Также глюкоза обладает альдегидной группой (-CHO). Эти группы делают глюкозу поларной молекулой.
Вода также является поларным соединением, благодаря особой структуре молекулы. У молекулы воды имеются два электронных облака: одно около атома кислорода и два около атомов водорода. Благодаря этому, молекула воды обладает дипольным моментом, где кислородная часть является отрицательно заряженной, а водородные атомы являются положительно заряженными.
Из-за поларности глюкозы и воды, образуются межмолекулярные силы притяжения, называемые водородными связями. Дипольные моменты молекул глюкозы и воды притягиваются друг к другу, образуя устойчивое соединение.
Таким образом, поларность глюкозы и воды обуславливает их хорошую растворимость друг в друге. Это объясняет, почему глюкоза может легко диссоциировать в воде и становиться доступной клеткам для использования в процессах метаболизма.
| Молекула | Полярность |
|---|---|
| Глюкоза | Полярная |
| Вода | Полярная |
Гидратация и электростатическое притяжение
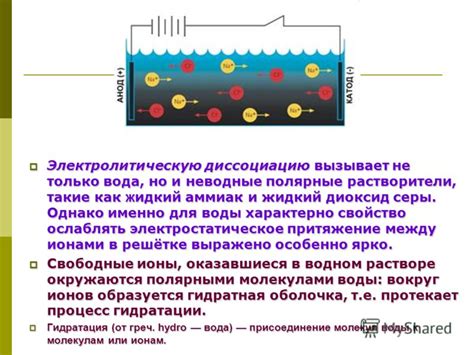
Гидратация происходит благодаря сильным электростатическим взаимодействиям между положительно заряженными водными молекулами и отрицательно заряженными атомами глюкозы. Кислородные атомы и атомы углерода в глюкозной молекуле имеют частичные отрицательные заряды, которые притягивают положительно заряженные протоны воды.
Электростатическое притяжение между водными молекулами и глюкозой сильно увеличивает межмолекулярные силы воды и делает растворение глюкозы очень эффективным процессом.
Благодаря гидратации и электростатическому притяжению, глюкоза может полностью раствориться в воде, образуя однородный раствор без осадка или сгустков.
Роль воды как растворителя

Вода играет важную роль в растворении глюкозы и других веществ. Это связано с особыми свойствами воды, которые делают ее отличным растворителем для многих соединений.
Полярность
Вода является полярным молекулой, что означает, что она имеет неравномерное распределение зарядов. У молекулы воды есть отрицательно заряженная кислородная часть и две положительно заряженные водородные части. Это делает воду хорошим растворителем для веществ, которые также являются полярными или ионными.
Водородные связи
Молекулы воды способны образовывать водородные связи друг с другом. Водородная связь возникает, когда атом водорода молекулы воды притягивается к отрицательно заряженному атому в другой молекуле. Это обеспечивает структурное целостность жидкой воды и делает ее способной растворять множество веществ, включая глюкозу.
Универсальный растворитель
Вода также считается универсальным растворителем, потому что она способна растворять большинство распространенных веществ. Это объясняется комбинацией ее полярности и способности образовывать водородные связи. Глюкоза, будучи поларной молекулой, может быть легко растворена в воде благодаря ее свойствам растворителя.
Таким образом, вода играет важную роль в растворении глюкозы и обладает свойствами, которые делают ее эффективным и универсальным растворителем для нескольких соединений.