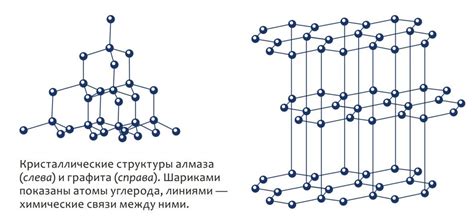
Графит и алмаз - две разные формы углерода. Причиной их такого существенного отличия является особая структура и взаимное расположение атомов в этих материалах. Поэтому, несмотря на то, что оба материала состоят из углерода, они обладают разными физическими и химическими свойствами.
Графит представляет собой сложную трехмерную структуру, состоящую из атомов углерода, которые соединены в шестиугольные кольца. Этот материал обладает кристаллической решеткой, которая образует слои, прикрепленные друг к другу слабыми связями ван-дер-Ваальса. Благодаря такой структуре, графит обладает мягкостью и слабой связью между слоями, что позволяет атомам углерода смещаться друг относительно друга.
Алмаз же имеет совершенно другую структуру. Он представляет собой кристалл, в котором каждый атом углерода тесно связан с другими атомами сильными химическими связями. В результате этого, алмаз обладает высокой твердостью и прочностью, так как его атомы углерода трудно перемещаются относительно друг друга. Это объясняет, почему алмаз является одним из самых твердых материалов на Земле.
Графит: мягкий материал с удивительными свойствами

Ответ кроется в структуре и расположении атомов внутри каждого из этих материалов. В графите атомы углерода соединены в слои плоских шестиугольников, которые образуют гексагональную решетку. При этом, слои атомов углерода легко сдвигаются друг относительно друга, что придает графиту его мягкость.
Алмаз, с другой стороны, имеет трехмерную кристаллическую решетку, в которой каждый атом углерода тесно связан с соседними атомами. Именно благодаря этой структуре алмаз является одним из самых твердых материалов на земле.
Помимо своей мягкости, графит также обладает другими интересными свойствами. Он обладает низким коэффициентом трения, что делает его идеальным материалом для использования в смазках. Графит также является хорошим проводником электричества и тепла, что позволяет использовать его в электродных приборах и системах охлаждения.
Атомная структура графита
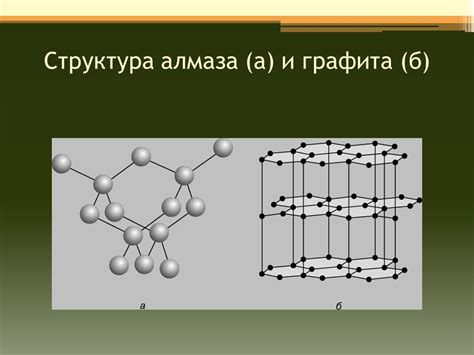
В то время как углеродные атомы внутри одного слоя графита связаны ковалентными связями, между слоями существуют слабые ван-дер-ваальсовы силы, которые не так сильно удерживают эти слои вместе. Именно это явление и дает графиту его слоистую структуру.
| Атомный слой | Другие атомы с которыми связан |
|---|---|
| Слой 1 | 3 |
| Слой 2 | 3 |
| Слой 3 | 3 |
| Слой 4 | 3 |
Из-за слабой связи между слоями атомов, эти слои легко скользят друг относительно друга, что придает графиту свою характерную мазючую текстуру. Также, это объясняет низкую твердость графита, так как слабое взаимодействие между слоями позволяет легко разрушать эти слои.
В отличие от графита, алмаз обладает кристаллической структурой, в которой каждый атом углерода связан с четырьмя другими атомами. Это образует трехмерную массивную структуру, в которой сильные ковалентные связи существуют во всех направлениях. Именно это явление и придает алмазу его высокую твердость и прочность.
Разница в строении графита и алмаза
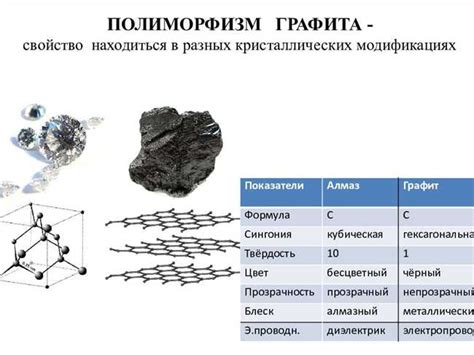
Графит представляет собой слоистое вещество, состоящее из шестиугольных плоскостей атомов углерода, соединенных ковалентными связями. Атомы углерода в графите образуют плоские слои в виде гексагональной решетки, которые легко сдвигаются друг относительно друга. Именно из-за этой структуры графит обладает мягкостью и смазывающими свойствами.
В отличие от графита, алмаз имеет кристаллическую структуру, в которой каждый атом углерода соединен с другими атомами через тетраэдрические связи. В результате образуется трехмерная кристаллическая решетка, которая придает алмазу высокую твердость и прочность. Каждый атом углерода в алмазе занимает фиксированное положение, что делает материал неподвижным и твердым.
Таким образом, главная причина различия в мягкости графита и твердости алмаза заключается в их разном строении на молекулярном уровне. Гексагональная структура графита позволяет слоям перемещаться относительно друг друга, что делает материал мягким. В то же время, трехмерная кристаллическая решетка алмаза делает его твердым и неподвижным.
Интермолекулярные силы в сетке графита
Причина этого различия кроется в особенностях структуры и взаимодействия атомов в графите и алмазе. В графите атомы углерода образуют двумерную гексагональную сетку, названную графеном. Такая структура образует слои, которые легко скользят друг по другу при небольшом приложенном давлении, придающем ему мягкость. Интермолекулярные силы (преимущественно слабые ван-дер-Ваальсовы силы) действуют между слоями графита. Эти силы не требуют сильного разрыва связей между атомами, поэтому слои легко скользят друг по другу.
В алмазе структура углерода представляет собой трехмерную решетку, в которой каждый атом углерода связан с соседними атомами четырьмя ковалентными связями, образуя tetrahedral sp3-гибридизацию. Эти связи являются очень прочными и требуют значительного количества энергии для их разрыва. Поэтому алмаз обладает высокой твёрдостью.
Таким образом, интермолекулярные силы между слоями графита позволяют ему легко скользить, что делает его мягким, в то время как прочная трехмерная структура алмаза делает его твёрдым материалом.
Практическое применение графита и алмаза
Графит
- Стержни и втулки для механических карандашей.
- Электроды для электрохимических реакций и аналитических инструментов.
- Смазки и смазочные материалы во многих отраслях промышленности.
- Термостойкие материалы, используемые в керамической и металлургической промышленности.
- Аноды для электролиза и высокотемпературных аккумуляторов.
Алмаз
- Инструменты для точной обработки материалов, такие как сверла, режущие пластины и алмазные диски.
- Индустриальные сегменты для шлифовки, фасовки и полировки различных поверхностей.
- Шлифовальные круги и диски для обработки стекла, камня и других твердых материалов.
- Оптические компоненты для лазерных систем и прецизионных оптических приборов.
- Бриллиантовые украшения, используемые в ювелирной промышленности.
Таким образом, графит и алмаз имеют широкое применение в различных отраслях, обеспечивая уникальные свойства и характеристики, которые позволяют им быть неотъемлемой частью современного мира промышленных и научных достижений.



