Хлор является одним из самых известных химических элементов, который часто используется в промышленности и жизни человека. Производные хлора широко применяются в производстве пластмасс, средствах бытовой химии, а также в процессе очистки воды. Один из интересных фактов о хлоре – это то, что у него существуют различные изотопы. Интересно, что несмотря на различие в массе этих изотопов, они оказываются полностью идентичными по своим химическим свойствам.
Изотопы – это атомы одного и того же элемента, но с различной массой. В случае с хлором, у него существуют два главных стабильных изотопа, которые называются хлор-35 и хлор-37. Хлор-35 содержит 17 нейтронов, а хлор-37 – 18 нейтронов. Различие в массе этих изотопов объясняется разностью в количестве нейтронов в их ядрах.
Важно отметить, что несмотря на различие в массе изотопов хлора, их химические свойства оказываются абсолютно идентичными. Это объясняется тем, что химические свойства элемента определяются его электронной структурой, а не количеством нейтронов в ядре. В случае с хлором, все атомы этого элемента имеют по 17 электронов, что является ключевым фактором, определяющим его химические свойства.
Изотопы хлора: особенности и свойства

- Хлор-35 является наиболее распространенным изотопом хлора и составляет около 75% всех атомов хлора на Земле. Его массовое число равно 35 и он обладает 17 протонами и 18 нейтронами в ядре.
- Хлор-37 - второй по распространенности изотоп хлора, составляющий примерно 25% всех атомов хлора. Его массовое число равно 37 и он содержит 17 протонов и 20 нейтронов в ядре.
Изотопы хлора имеют одинаковую химическую активность, поскольку они имеют одинаковую электронную конфигурацию и обладают одинаковым количеством электронов во внешнем энергетическом уровне. Это означает, что они взаимодействуют с другими элементами и соединениями таким же образом.
Особенностью изотопов хлора является их способность образовывать различные химические соединения. Например, хлор-35 и хлор-37 могут образовывать соль с натрием (NaCl), но при этом их массовые отношения в различных образцах соли могут отличаться. Это имеет значение в изотопной геологии, где изотопный состав хлора может использоваться для определения возраста и происхождения геологических образцов.
Таким образом, изотопы хлора, несмотря на различия в количестве нейтронов в их ядрах, обладают сходными химическими свойствами и представляют собой важные инструменты для науки и промышленности.
История открытия и изучения хлора

Первые упоминания о веществе, похожем на хлор, датируются III веком до н.э. В античный период некоторые ученые заметили его обеззараживающие свойства, хотя они не понимали его истинной природы.
В ходе развития науки и технологий, изучение хлора стало более систематичным. В начале XIX века французский ученый Антуан Лавуазье впервые назвал это вещество "хлор" (от греческого "chloros", что означает "зеленый"), а также определил его химические свойства.
В середине XIX века химики начали проводить эксперименты, которые помогли понять, что хлор является элементом и имеет несколько изотопов. Ученые определили, что атом хлора состоит из 17 протонов в ядре и различается по количеству нейтронов – это и объясняет появление изотопов хлора.
Открытие изотопов хлора помогло ученым понять, почему они имеют одинаковые химические свойства. Изотопы хлора имеют одно и то же количество протонов и электронов, что определяет их химические свойства и взаимодействия с другими элементами.
Исследование свойств хлора продолжается и по сей день, и это важный элемент для многих областей науки и технологий, включая производство пластиков, дезинфекцию воды, производство лекарств и многое другое.
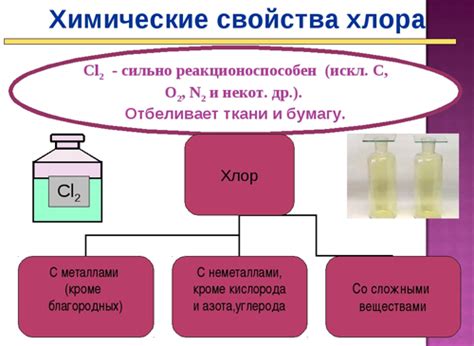
Химические свойства хлора
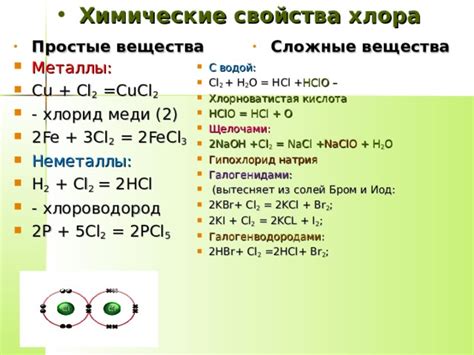
У хлора есть несколько изотопов, но они оказывают малое влияние на его химические свойства. Основной изотоп хлора, хлор-35 (35Cl), составляет около 76% всех атомов хлора, а изотоп хлор-37 (37Cl) составляет около 24%. Оба изотопа имеют одинаковое количество электронов и протонов, что объясняет их схожие химические свойства.
Хлор является очень реактивным элементом и может образовывать соединения с большинством других элементов. Он может сильно окисляться или редуцироваться в химических реакциях. Наиболее распространенные соединения хлора включают хлориды, такие как натрий хлорид (NaCl) и кальций хлорид (CaCl2).
Хлор также активно используется в промышленности и в бытовых целях. Например, его использование в процессе очистки воды избавляет ее от микроорганизмов и бактерий. Также, хлор используется в качестве отбеливающего агента в производстве бумаги и текстиля.
В общем, хлор обладает разнообразными химическими свойствами, которые делают его важным элементом во многих отраслях промышленности и быта.
Понятие об изотопах и их отличия от других видов атомов

Отличие изотопов от других видов атомов заключается в их массовом числе. Благодаря наличию дополнительных или отсутствию некоторых нейтронов в ядре, массовое число изотопов может отличаться от обычных атомов. Например, в случае хлора, обычные атомы имеют массовое число 35, а его изотопы могут иметь массовое число 36 или 37.
Массовое число - это сумма числа протонов и нейтронов в ядре атома. Оно указывается в верхнем индексе левее химического символа элемента. Например, для хлора 35 это будет выглядеть как 35Cl, а для хлора 37 - 37Cl.
В то же время, изотопы имеют одинаковые химические свойства, так как электронная структура атома, которая определяет его химическое поведение, не зависит от числа нейтронов в ядре. Это позволяет изотопам хлора проявлять одинаковую реактивность в химических реакциях.
Изотопы могут иметь разное стабильное или нестабильное состояние: некоторые из них радиоактивны и подвергаются распаду, другие остаются стабильными на протяжении длительного времени. В случае хлора, его наиболее распространенные изотопы - хлор-35 и хлор-37 - являются стабильными.
Изотопы хлора: общие характеристики

Изотоп хлор-35 представляет собой наиболее распространенный изотоп хлора. Он содержит 18 нейтронов в ядре и его атомная масса равна примерно 35 единицам атомной массы. Изотоп хлор-37 содержит 20 нейтронов и его атомная масса примерно равна 37 единицам атомной массы.
Несмотря на отличие в атомных массах, изотопы хлора обладают схожими химическими свойствами. Это объясняется тем, что химические свойства элемента определяются его электронной конфигурацией, а количество и расположение электронов в атоме хлора не зависит от его атомной массы или числа нейтронов.
Таким образом, хлор-35 и хлор-37 могут участвовать в тех же химических реакциях, образуя аналогичные соединения и проявляя схожие свойства. Изотопы хлора одинаково хорошо растворяются в воде и проявляют схожее поведение при взаимодействии с другими веществами.
Атомные и физические свойства изотопов хлора
Изотопы хлора, как и все изотопы, обладают одинаковым количеством протонов в ядре, что определяет их атомный номер и химические свойства. Различия между изотопами хлора заключаются в их массовом числе и количестве нейтронов в ядре.
Самым распространенным изотопом хлора является хлор-35, который имеет 17 протонов и 18 нейтронов в ядре. Его массовое число равно 35. Изотоп хлор-35 составляет около 76% всего естественного хлора на Земле.
Существует также другой изотоп хлора - хлор-37. Он имеет 17 протонов и 20 нейтронов в ядре, что делает его массовое число равным 37. Доля изотопа хлор-37 в природном хлоре составляет около 24%.
Так как хлор-35 и хлор-37 имеют одинаковое количество электронов и протонов в своих атомах, атомные и химические свойства этих изотопов практически не отличаются друг от друга. Это означает, что они образуют одинаковые химические соединения и проявляют схожие реакции.
Тем не менее, изотопы хлора могут отличаться в своих физических свойствах. Например, изотоп хлор-37 имеет большее массовое число, что может повлиять на его плотность и теплоемкость. Также, изотопы хлора могут иметь различную устойчивость и время полураспада, что важно при использовании исотопов в научных и медицинских целях.
В целом, хлор-35 и хлор-37 являются очень похожими по своим химическим и атомным свойствам. Однако, изучение и понимание различий между этими изотопами хлора играет важную роль в различных областях науки, технологии и медицины.



