Кислород – один из самых распространенных элементов в природе. Наиболее известными соединениями кислорода являются вода и диоксид углерода. Изучение химических свойств и структуры кислорода важно для понимания многих процессов, происходящих в нашей жизни.
Степень окисления – это некий "знак" или "отпечаток", который оставляет атом в данном химическом соединении. Он показывает, сколько электронов перешло с атома или на атом в процессе химической реакции. Для кислорода степень окисления обычно равна 2, что означает, что каждый атом кислорода имеет два валентных электрона.
Почему именно 2? Кислород – электроотрицательный элемент, то есть он имеет большую способность притягивать электроны. В молекуле воды (Н2О), каждый атом кислорода образует ковалентные связи с двумя атомами водорода общими электронными парами. Каждая из этих связей представляет собой "дар" двух электронов кислороду. Таким образом, общая степень окисления кислорода в молекуле воды составляет 2.
Кислород: особенности и свойства
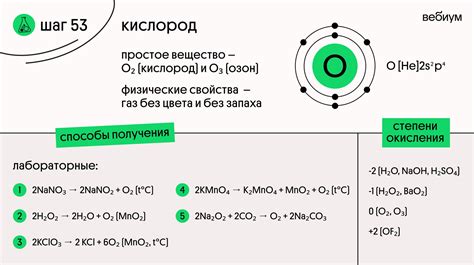
Свойства кислорода:
- Газообразное состояние: Кислород - газ, который находится в атмосфере Земли на высоте около 100 километров от поверхности земли, и составляет около 21% объема атмосферы.
- Бесцветность: Кислород - бесцветный газ, что делает его неуловимым для человеческого глаза. Однако он может быть обнаружен через реакции с другими веществами.
- Поддержание горения: Кислород - реактивный газ, поддерживающий сгорание. Благодаря этому свойству, он используется для поддержания огня в различных процессах и системах.
- Высокая растворимость: Кислород имеет высокую растворимость в воде, что позволяет ему проникать в организмы и обеспечивать дыхание рыб и других водных организмов.
Степень окисления кислорода - 2, что означает, что он может образовывать соединения, в которых каждый атом кислорода имеет 2 электрона, обычно в соединениях, какими являются оксиды.
Кислород является жизненно важным для многих организмов, включая человека. Он участвует в процессах дыхания и метаболизма, генерирует энергию, необходимую для жизнедеятельности клеток.
Структура и состав кислорода
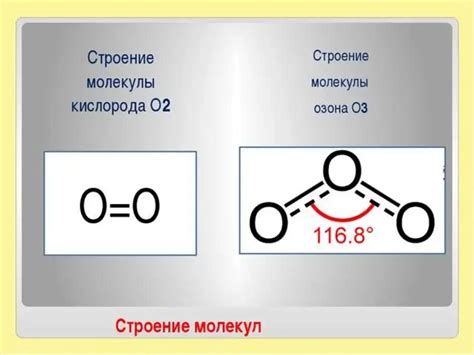
Структура кислорода представляет собой молекулярный газ, состоящий из двух атомов, связанных двойной ковалентной связью. Каждый атом обладает 6 внешними электронами, что означает их непарность. При образовании двойной связи между атомами кислорода эти электроны совместно используются обоими атомами. Это делает молекулу кислорода устойчивой и неделимой.
Кислород, имея двухатомную структуру, является диатомным газом и обладает высокой энергией связи между атомами. Это делает его очень реакционноспособным и электроотрицательным элементом. Благодаря этому свойству кислород образует соединения с другими элементами, оказывая разностороннее воздействие на природные и химические процессы.
Основными соединениями кислорода являются оксиды, где степень окисления кислорода составляет -2. В таких соединениях кислород склонен принимать электроны от других элементов, при этом его степень окисления становится отрицательной. Возможно и более высокие степени окисления кислорода, однако они редки и обычно встречаются в сложных соединениях.
Роли и функции кислорода в организмах
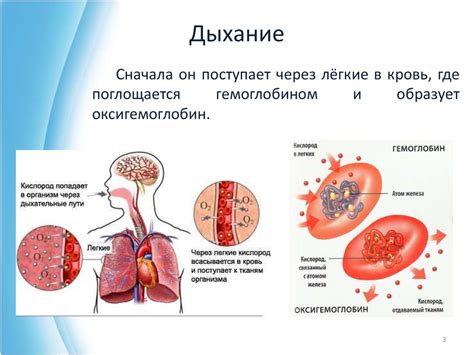
Один из основных процессов, в котором участвует кислород, - это окисление пищевых веществ с целью получения энергии. В процессе клеточного дыхания кислород окисляется до воды, а в результате этой реакции выделяется энергия, необходимая для функционирования организма. Кислород также участвует в других процессах обмена веществ, например, в окислительно-восстановительных реакциях, которые происходят в клетках.
Кислород играет важную роль в дыхательной и сердечно-сосудистой системах. Он не только является основным компонентом вдыхаемого воздуха, но и переносится через легкие в кровь, где связывается с гемоглобином, образуя оксигемоглобин. Это позволяет переносить кислород из легких во все ткани и органы организма. Благодаря кислороду клетки получают необходимое количество кислорода для своей работы.
Кроме того, кислород играет важную роль в иммунной системе. Он участвует в процессе фагоцитоза, при котором белые кровяные клетки поглощают и уничтожают микроорганизмы и другие возбудители инфекций. Кислород также помогает активировать фагоциты и усиливает их защитные функции.
Особую роль кислород играет в мозге. Мозг потребляет около 20% всего потребляемого организмом кислорода. Недостаток кислорода может привести к головной боли, головокружению и другим проблемам с мозговой деятельностью. Поэтому достаточное и правильное поступление кислорода к мозгу является одним из ключевых факторов для его здоровья и работоспособности.
Необходимость кислорода в организмах выявлена еще в XIX веке благодаря работам Лавуазье и Люкас Штерна. С их открытий начинается более глубокое изучения роли и функций кислорода, что имеет прямое отношение к различным областям науки и медицины.
| Роли и функции кислорода: |
|---|
| 1. Участие в клеточном дыхании и обмене веществ |
| 2. Перенос кислорода в крови |
| 3. Участие в иммунной системе |
| 4. Регуляция работы мозга |
Кислород в атмосфере и его уровень окисления
В атмосфере кислород существует в виде газа, обозначаемого символом O2. Уровень окисления кислорода в молекуле O2 составляет 0. Это означает, что каждый атом кислорода в молекуле несет нейтральный заряд.
Однако, во многих химических соединениях кислород имеет степень окисления 2-. Например, в воде (H2O) каждый атом кислорода образует две ковалентные связи с атомами водорода и при этом приобретает отрицательный заряд -2.
Степень окисления кислорода зависит от окружающих его атомов или групп атомов. Когда кислород связывается с другими элементами, он способен принимать на себя электроны, что ведет к изменению его степени окисления.
Существуют также вещества, в которых степень окисления кислорода отличается от 2. Например, в перекиси водорода (Н2О2) каждый атом кислорода имеет степень окисления -1.
| Вещество | Молекулярная формула | Степень окисления кислорода |
|---|---|---|
| Кислород | O2 | 0 |
| Вода | H2O | -2 |
| Перекись водорода | H2O2 | -1 |
Знание степени окисления кислорода в различных веществах позволяет химикам понять, как происходят химические реакции и взаимодействия между элементами и соединениями. Это важно для понимания многих процессов, которые происходят в природе и промышленности.
Уровень окисления кислорода в соединениях
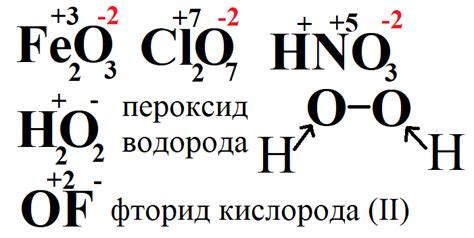
Для большинства соединений кислорода его степень окисления равна 2. Например, водный пар (H2O), оксид углерода (CO2) и пероксид водорода (H2O2) содержат кислород со степенью окисления 2.
Однако, существуют и исключения, когда кислород имеет степень окисления отличную от 2. Например, в хлорате калия (KClO3) кислород имеет степень окисления +5, а в перекиси натрия (Na2O2) -1.
Степень окисления кислорода в соединениях может быть определена с помощью правил определения степени окисления, учитывая заряды других элементов и общий заряд соединения. Это позволяет более точно определить уровень окисления кислорода и его роль в химических реакциях и свойствах соединений.
- Водный пар (H2O) - степень окисления кислорода: 2
- Оксид углерода (CO2) - степень окисления кислорода: 2
- Пероксид водорода (H2O2) - степень окисления кислорода: 2
- Хлорат калия (KClO3) - степень окисления кислорода: +5
- Перекись натрия (Na2O2) - степень окисления кислорода: -1
Значение степени окисления кислорода в химических реакциях
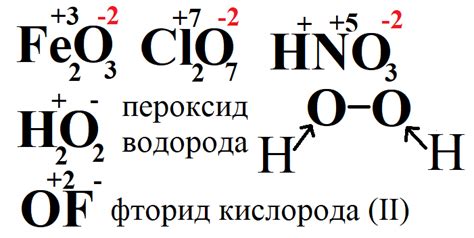
Степень окисления кислорода обозначает, сколько электронов кислород делит или передает в химической реакции. Обычно кислород имеет степень окисления -2 (в соединении с другими элементами), но иногда она может быть и другой.
В ряде соединений, таких как перекись водорода (Н2O2), кислород имеет степень окисления -1. Для простых оксидов, таких как диоксид углерода (CO2) или оксид железа(II) (FeO), кислород имеет степень окисления -2.
Однако, кислород может также иметь положительную степень окисления в таких соединениях, как пероксиды. Например, водород пероксид (Н2O2) имеет степень окисления кислорода -1. В пероксидах кислород обладает степенью окисления -1.
Знание степени окисления кислорода позволяет понять его роль в химических реакциях. Кислород, имеющий степень окисления -2, обычно является окислителем, передающим электроны другим элементам. Кислород с положительной степенью окисления может выступать в качестве соединения восстановителя, принимая электроны от других элементов.
Степень окисления кислорода играет важную роль в определении свойств и поведения многих соединений. Она позволяет установить природу химической связи и предсказать химическую активность вещества. Поэтому изучение степени окисления кислорода является важным аспектом химии и позволяет более глубоко понять органические и неорганические реакции, где участвует кислород.