Кислород – один из самых распространенных элементов в природе, играющий важную роль во многих физических и химических процессах. Обладающий атомным номером 8 в периодической таблице, кислород обычно образует две связи с другими элементами, проявляя свою валентность в 2. Но почему же кислород не образует больше связей и не проявляет валентность 6, как, например, сера или селен?
Дело в электронной конфигурации атома кислорода. Кислород имеет 6 электронов в своей валентной оболочке, и, исходя из основных правил химии, он должен образовывать 6 связей, чтобы достигнуть полностью заполненной оболочки. Однако, физическая реальность ограничивает проявление данной валентности у кислорода в 6. Почему?
Причина заключается в энергетической нестабильности. Кислород образует двухкратную связь с другими элементами, что позволяет ему заполнить свою валентную оболочку, но при образовании трехкратной или десятичной связи, энергетическая нестабильность системы возрастает. Кислород отдает предпочтение образованию более стабильных соединений, при которых его оболочка считается заполненной.
Кислород и его валентность

Кислород имеет электронную конфигурацию 1s2 2s2 2p4. Это означает, что у него есть 6 внешних электронов, которые могут участвовать в связях с другими атомами.
Однако, кислород обычно проявляет валентность равную 2. Это связано с его высокой электроотрицательностью и стремлением заполнить свою внешнюю электронную оболочку, имея полный октет (8 электронов).
Валентность 2 означает, что кислород может образовывать две химические связи с другими атомами. Например, воде (H2O) он образует две связи с атомами водорода. Также, кислород может образовывать двойные связи, например, в молекуле углекислого газа (CO2).
Почему кислород не проявляет валентность 6? Валентность 6 означала бы, что кислород может образовывать шесть связей с другими атомами. Однако, это противоречило бы его электронной конфигурации и стремлению к полному октету. Кроме того, образование такого большого количества связей сильно нарушило бы структуру и устойчивость молекул, в которых кислород участвует.
Таким образом, кислород обычно проявляет валентность 2, чтобы достичь электронной стабильности и образовывать устойчивые химические соединения.
Понятие валентности

Валентность элемента характеризует способность атома данного элемента образовывать связи с другими атомами. Валентность элемента определяется количеством электронов в его внешней электронной оболочке и определяет число связей, которые элемент может образовать.
Валентность обычно указывается римскими цифрами и может быть положительной или отрицательной. Положительная валентность означает, что элемент может отдать свои электроны и образовать положительно заряженные ионы. Отрицательная валентность, напротив, указывает на способность элемента приобретать электроны и образовывать отрицательно заряженные ионы.
Как правило, валентность атома соответствует числу его валентных электронов. Однако существуют исключения, когда атомы могут образовывать связи, не соответствующие их валентности. Примером такого исключения является кислород, который имеет валентность 2, но может образовывать связи с валентностью 1 или 3.
Кислород в основном образует двойные связи, в результате которых его валентность становится равной 2. Однако при особом строении молекулы или при наличии особого вещества, кислород может образовывать одинарные или тройные связи. В таких случаях, кислород меняет свою валентность и может образовывать связи с валентностью 1 или 3. При этом число образованных связей всегда суммируется до 2, что является основным исполнением валентности кислорода.
| Валентность | Количество электронов в валентной оболочке | Примеры элементов |
|---|---|---|
| 1 | 1 | Водород (H) |
| 2 | 2 | Кислород (O) |
| 3 | 3 | Бор (B) |
Особенности валентности кислорода
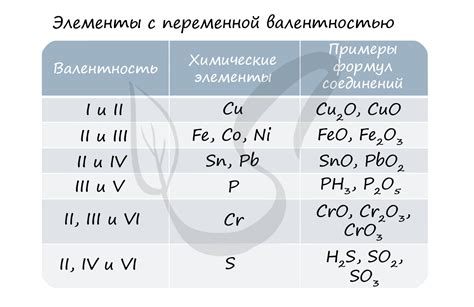
Кислород обладает двуми электронами в валентной оболочке, что делает его стабильным и малоактивным. В связи с этим, кислород редко проявляет валентность 6, то есть способность участвовать в химических реакциях, где он может принять или передать шесть электронов.
Однако, существуют исключения, когда кислород проявляет валентность 6. Например, в некоторых соединениях, таких как пероксиды и супероксиды, кислород образует связи, в которых участвует шесть электронов. Пероксиды содержат одну связь с валентностью 6 между двумя атомами кислорода, а супероксиды содержат две связи с валентностью 6.
Важно отметить, что эти соединения кислорода с валентностью 6 являются нестабильными и реактивными. Они обладают окислительными свойствами и могут участвовать в различных химических процессах.
| Соединение | Формула | Валентность кислорода |
|---|---|---|
| Пероксид водорода | H2O2 | 6 |
| Пероксид бария | BaO2 | 6 |
| Супероксид калия | KO2 | 6 |
Электронная конфигурация кислорода

Кислород (O) имеет атомный номер 8, что означает, что у него есть 8 электронов. В его электронной оболочке находятся два электрона на первом энергетическом уровне и шесть электронов на втором энергетическом уровне.
Электронная конфигурация кислорода может быть записана следующим образом: 1s2 2s2 2p4. Это означает, что первый энергетический уровень заполнен двумя электронами в 1s-орбитали и второй энергетический уровень заполнен шестью электронами - двумя электронами в 2s-орбитали и четырьмя электронами в 2p-орбиталях.
Эта электронная конфигурация позволяет кислороду обладать стабильной электронной структурой. Заполненные энергетические уровни делают его относительно неподвижным и мало реактивным элементом. Валентность кислорода обычно равна 2, так как он может получить или разделить два электрона, чтобы достичь октета - полностью заполненной внешней энергетической оболочки.
Таким образом, кислород не проявляет валентность 6, потому что его электронная конфигурация не позволяет ему получить или потерять шесть электронов, чтобы достичь октета.
Связывание кислорода с другими элементами

Кислород, как элемент, обладает валентностью 2, что означает, что он может образовывать двойные связи с другими элементами. Однако, в ряде случаев кислород может также образовывать более сложные связи.
Кислород обычно связывается с другими элементами путем образования ковалентной связи, в которой пара электронов общая для обоих элементов.
Самая распространенная форма связывания кислорода - это образование одиночной связи с другим элементом. Например, водород может образовывать связи с кислородом воды, образуя молекулу H2O.
Кроме того, кислород может также образовывать связи с другими элементами, такими как азот, сера, фосфор и другие. В таких случаях кислород может образовывать двойные или тройные связи, в зависимости от количества электронных пар, доступных для связывания.
Таким образом, кислород может проявлять различную валентность в зависимости от типа связи, которую он образует с другими элементами.
Молекулярный кислород

Молекулярный кислород получает свою стабильность благодаря сильному связыванию атомов кислорода друг с другом при помощи двойной связи. Эта связь обладает высокой прочностью, что делает молекулу О2 стабильной и малоактивной в химических реакциях.
Каждый атом кислорода в молекуле О2 имеет валентность 2. Валентность означает количество связей, которые атом может образовать с другими атомами при формировании химических соединений. В случае кислорода в молекуле О2, оба атома уже образуют по две связи с другими атомами кислорода, что приводит к общей валентности молекулы равной 4. Это объясняет, почему кислород не проявляет валентность 6 в молекуле О2.
| Символ элемента | Имя элемента | Атомная масса | Валентность в молекуле О2 |
|---|---|---|---|
| O | Кислород | 16 | 2 |
Молекулярный кислород является необходимым для дыхания многих организмов, включая людей. Он играет ключевую роль в клеточном дыхании, процессе, при котором клетки преобразуют пищу в энергию. Кроме того, молекула О2 используется в процессе окисления многих органических соединений, таких как глюкоза, для выделения энергии.
Молекулярный кислород также широко используется в промышленности, медицине и науке. Он используется в процессе сварки, сжигания топлива, производства кислородных бомб и как окислитель для различных химических реакций. Кислородные баллоны также используются для поддержания дыхания пациентов в медицинских учреждениях.
Значение и применение кислорода

Важность кислорода для жизни
Кислород играет крайне важную роль в жизни всех организмов. Без него практически невозможно существование жизни на Земле. Воздух, составляющий около 21% кислорода, необходим для дыхания живых существ. Кислород позволяет организмам производить энергию, окисляя органические вещества в клетках через процесс кислородного обмена.
Применение кислорода в промышленности
Кислород активно используется в промышленных процессах. Он является необходимым компонентом для горения, и его наличие позволяет усиливать сжигание топлива, что повышает эффективность процессов нагрева и сварки. Кислород также используется в производстве различных химических соединений, включая множество важных промышленных продуктов.
Использование кислорода в медицине
Кислород имеет большое значение в медицине. Он используется при лечении различных заболеваний, таких как бронхиальная астма, обструктивная болезнь легких и пневмония. Кислородные концентраторы широко используются для предоставления пациентам кислорода в домашних условиях.
Кислород и экология
Кислород играет важную роль в поддержании экологического баланса. Фотосинтез, процесс, при котором растения используют солнечную энергию для превращения углекислого газа и воды в кислород и органические вещества, осуществляется благодаря кислороду. Кислород также необходим для микроорганизмов, живущих в воде, и поддерживает экосистемы водных бассейнов.