Кислород – один из самых известных и широко распространенных элементов в природе. Мы все знаем, что основной тип валентности кислорода равен двум. Однако, почему кислород не проявляет высшую валентность? Ведь у него есть два неспаренных электрона, которые могут образовывать химические связи.
Одной из причин отсутствия высшей валентности кислорода является его высокая электроотрицательность. Кислород – элемент, который стремится сильно притянуть к себе электроны от других атомов. Поэтому он более склонен к образованию двойной или тройной связей с другими элементами, чтобы получить стабильную структуру.
Другой важной причиной является геометрия молекулы. Кислород имеет характерную форму, у которой есть две свободные пары электронов. Эти свободные пары делают молекулу кислорода более анионной и делают основную валентность равной двум. Проявление высшей валентности требовало бы изменения геометрии молекулы и потенциального нарушения структуры, что энергетически невыгодно для кислорода.
Кислород и его валентность
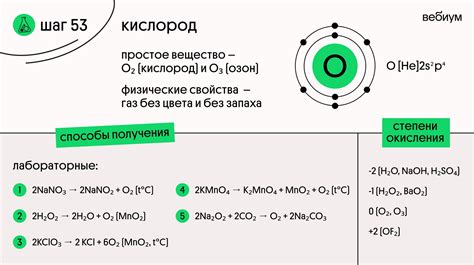
Как правило, кислород вступает в химические реакции, образуя двойные связи. Это связано с его электронной конфигурацией: у кислорода 6 валентных электронов, которые располагаются на внешнем энергетическом уровне. Каждый атом кислорода может сформировать две связи, используя свои два несвязанных электрона в различных соединениях.
Однако, хотя у кислорода есть потенциал для образования большего количества связей, валентная способность ограничена. Это связано с тем, что формирование новых связей требует энергии, и кислород предпочитает сохранять свое стабильное состояние, образуя двойные связи. Валентность кислорода определяется балансом между его склонностью к стабильности и желанием вступать в химические реакции с другими элементами.
Таким образом, хотя кислород имеет потенциал для проявления высшей валентности, его электронная конфигурация и физические свойства ограничивают его способность образовывать только двойные связи. Это делает кислород уникальным элементом, который играет важную роль в различных химических реакциях и жизненных процессах на Земле.
Что такое валентность?
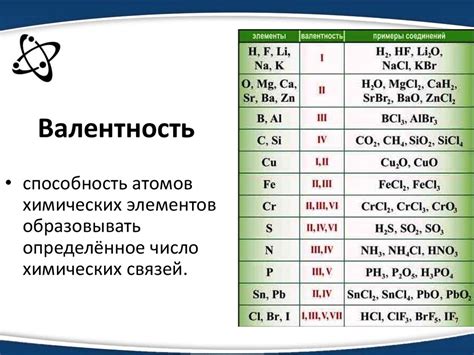
Атомы стремятся заполнить свою внешнюю электронную оболочку электронами, чтобы достичь наиболее устойчивого состояния, имеющего аналогию с конфигурацией эдельгейна. Валентность атома определяется числом валентных электронов, находящихся на его внешней энергетической оболочке, которые он может использовать для образования связей с другими атомами.
Валентность атомов может быть положительной или отрицательной. Положительная валентность указывает на то, что атом может отдать одно или несколько электронов, образуя положительный ион. Отрицательная валентность означает, что атом может принять одно или несколько электронов и стать отрицательно заряженным ионом.
Кислород (О) известен своей валентностью 2, что означает, что он может образовывать две связи с другими атомами. На его внешней электронной оболочке находятся шесть электронов, два из которых являются валентными. Валентность кислорода обуславливает его способность образовывать такие молекулы, как вода (H2O) и диоксид углерода (CO2).
Особенности кислорода

| Символ | O |
| Атомный номер | 8 |
| Относительная атомная масса | 15,999 |
| Плотность при 20 °C | 1,429 г/см³ |
| Точка кипения | -183 °C |
| Точка плавления | -218 °C |
Одной из особенностей кислорода является его высокая реакционная способность. Он легко вступает в химические реакции с другими веществами и осуществляет окисление. Благодаря этому кислород играет важную роль в организации жизненных процессов, таких как дыхание и окисление пищи.
Кислород также обладает способностью образовывать молекулы и иметь различные степени окисления. Однако, несмотря на свою высокую реакционность, кислород не проявляет высшую валентность. Это связано с его электронной конфигурацией и структурой атома.
Каждый атом кислорода имеет 6 электронов в своей внешней электронной оболочке. Он стремится заполнить ее до 8 электронов, что соответствует электронной конфигурации инертного газа неона. В результате кислород образует двойные связи, достигая октетного состояния. Это объясняет его способность образовывать соединения с другими элементами, но не проявлять высшую валентность.
Необходимо отметить, что высшая валентность характерна для некоторых других элементов, таких как сера и фосфор. Однако, кислород, используя свою способность образовывать двойные связи, активно участвует во множестве химических реакций, оказывая огромное влияние на механизмы жизнеобеспечения организмов.
Факторы, влияющие на валентность кислорода
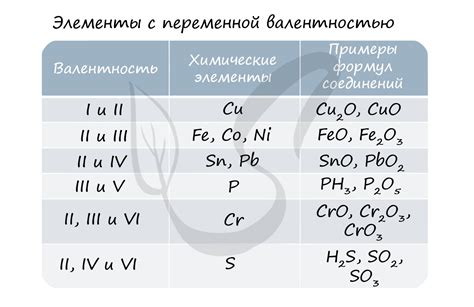
Кислород (O) в основном проявляет валентность 2, что означает, что он способен образовывать две связи с другими атомами.
Однако, кислород также может проявлять валентность 1 в случае супероксидов (например, в перекиси водорода) и валентность 3 в пероксидах (например, в пероксиде водорода).
Какие факторы влияют на валентность кислорода?
1. Электронная конфигурация: Кислород имеет электронную конфигурацию 1s² 2s² 2p⁴. У него есть 4 валентные оболочки, что позволяет ему образовывать 2 связи, чтобы заполнить свою внешнюю оболочку и достичь стабильности.
2. Энергетика связи: Образование связи между атомами кислорода и других атомов целиком зависит от энергетического выигрыша, который получается от образования этой связи. Обычно, кислород формирует два одиночных связи, потому что энергетика этих связей является самой выгодной.
3. Закон Октета: Закон Октета гласит, что атомы стремятся заполнить свою внешнюю оболочку 8 электронами, чтобы достичь максимальной стабильности. Кислород только двумя связями может заполнить 8 электронов и, следовательно, достичь стабильности и следовать закону Октета.
Эти факторы влияют на то, почему кислород не проявляет высшую валентность, и почему он обычно образует две связи с другими атомами.
Электроотрицательность и валентность кислорода
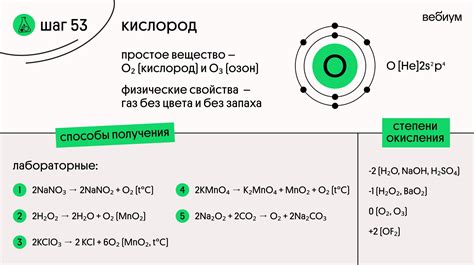
Однако, несмотря на это, кислород обычно проявляет только валентность равную 2 во многих своих соединениях. Это связано с электронной конфигурацией кислорода. В его внешнем электронном слое находятся 6 электронов, что делает его электронную конфигурацию 2s^22p^4. Кислород стремится достигнуть стабильности, заполнив свой внешний энергетический слой до максимального значения, равного 8 электронам.
Для достижения стабильности кислород может образовывать две ковалентные связи, каждая из которых предоставляет ему по два электрона. В результате кислород получает 4 дополнительных электрона, и его валентность составляет 2. Такая электронная конфигурация даёт кислороду возможность реализовывать множество соединений со многими другими элементами, включая воду, оксиды и молекулы органических соединений.
Отсутствие более высокой валентности у кислорода объясняется его относительно маленьким размером. Маленький размер кислородного атома не позволяет ему достаточно эффективно формировать связи с большим количеством других атомов. В результате кислород образует связи только с двумя атомами других элементов. Это делает валентность 2 наиболее стабильной и распространённой для кислорода в его соединениях.
Сравнение с другими элементами таблицы Менделеева
Подобно сере (S), селену (Se) и теллуру (Te), кислород способен образовывать соединения с высокой степенью окисления. Однако, в отличие от этих элементов, кислород не проявляет свою высшую валентность, которая у серы, селена и теллура равна 6. Это связано с особенностями его электронной конфигурации и структуры энергетических уровней.
Кислород имеет электронную конфигурацию 1s2 2s2 2p4. Его валентная оболочка состоит из шести электронов, что позволяет кислороду образовывать соединения с легкими элементами, такими как водород (H), углерод (C) и азот (N), образуя воду (H2O), углекислый газ (CO2) и азотистую кислоту (HNO3). Кислород не имеет свободных электронных орбиталей для образования трех- или четырехвалентных соединений, в то время как другие элементы группы 16 (сера, селен и теллур) имеют свободные d-электроны, которые могут участвовать в образовании соединений с валентностью 6.
Таким образом, кислород, хотя и способен образовывать соединения с высокой степенью окисления, не проявляет своей высшей валентности, что делает его особенным элементом в группе 16 таблицы Менделеева.