Ионная диссоциация - это процесс, в результате которого кислоты разлагаются на ионы при контакте с водой. Однако, почему это происходит и почему именно на ионы? Вопросы, на которые могут знать ответ лишь химики и ученые.
Научная теория ионной диссоциации была впервые представлена в XIX веке, когда были установлены основные принципы данного явления. Согласно этой теории, кислоты диссоциируют ступенчато на ионы в водном растворе, потому что между молекулами кислоты существуют слабые связи, которые разрываются под воздействием воды. Таким образом, образование ионов кислоты и происходит.
Известно, что кислоты могут образовывать различные ионы, такие как гидроген-ионы (H+), гидроксид-ионы (OH-) и другие. Эти ионы являются основными игроками в различных химических реакциях и имеют огромное значение в биологии, медицине и промышленности.
Правда о диссоциации кислот может быть сложной для понимания, однако она имеет огромное значение в химической науке. Благодаря этому процессу мы можем понимать, как происходят многие химические реакции и как взаимодействуют различные вещества в природе и научной лаборатории. Ионная диссоциация - одна из важнейших химических реакций, которая продолжает удивлять и вдохновлять людей из разных областей науки.
Механизм диссоциации кислот на ионы
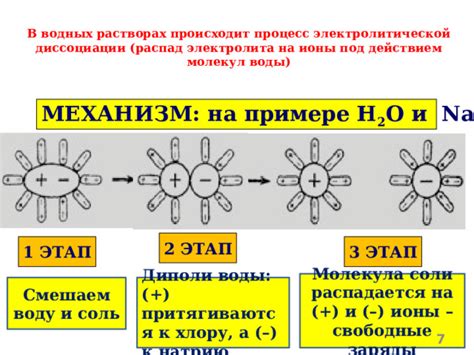
Сначала молекула кислоты находится в нейтральном состоянии и не образует ионов. Однако при попадании водных молекул, происходит образование гидроксиона (OH-) и протона (H+). Гидроксион образуется путем отрыва одного или нескольких водородных ионов от молекулы кислоты, в результате образуется отрицательно заряженный ион.
Процесс диссоциации кислоты на ионы не протекает равномерно и зависит от таких факторов, как концентрация кислоты, температура, растворитель и наличие других веществ.
Важным аспектом механизма диссоциации кислоты на ионы является реакция их с водными молекулами. В результате этой реакции образуются два важных иона - гидроксион и протон. Гидроксион играет роль основания и образует щелочную среду, а протон - роль кислоты и образует кислую среду.
Почему кислоты обладают свойством диссоциировать

Для объяснения этого явления применяется теория Бронстеда-Лоури, которая основана на следующих принципах:
1. Кислоты – это вещества, способные отдавать протоны (водородные ионы, H+).
2. Базы – это вещества, способные принимать протоны.
Внутри молекулы кислоты есть функциональная группа, которая содержит атом водорода, связанный с другим атомом или группой. Как только кислота попадает в раствор, эта функциональная группа может отдать протон (H+), образуя положительный ион, называемый катионом. Таким образом, происходит ионная диссоциация кислоты.
Примером ионной диссоциации является реакция между соляной кислотой (HCl) и водой (H2O):
HCl + H2O → H3O+ + Cl-
В этой реакции молекула HCl отдает протон H+, который становится связан с молекулой воды и образует гидронийный ион (H3O+). Ион Cl- образуется за счет отщепления атома хлора от молекулы HCl.
Таким образом, кислоты обладают свойством диссоциировать благодаря способности отдавать протоны в растворе. Это свойство играет важную роль во многих химических реакциях и благодаря ему возможно образование различных ионов в растворе.
Влияние структуры кислот на диссоциацию
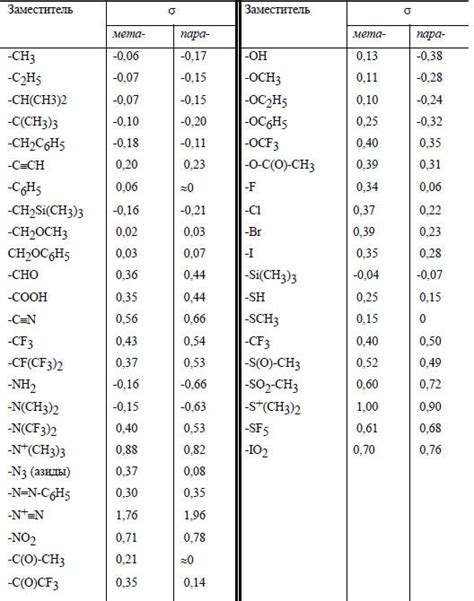
Одна из основных структурных особенностей кислоты - наличие кислородного атома, связанного с водородом. Такие кислоты, называемые оксокислотами, обычно обладают высокой кислотностью и диссоциируются на ионы ступенчато. Молекула оксокислоты содержит кислород, который может отдавать электроны, а также атом водорода, который привлекает электроны. Когда оксокислота попадает в воду, она диссоциирует, отдавая протон (H+) и образуя соответствующий отрицательный ион.
| Название кислоты | Формула | Примеры |
|---|---|---|
| Сильные монооксокислоты | HCl | Хлороводородная кислота |
| Слабые монооксокислоты | CH3COOH | Уксусная кислота |
| Двухосновные оксокислоты | H2SO4 | Серная кислота |
Однако есть также и другие типы кислот, которые могут диссоциировать на ионы несколько сложнее. Например, у полиоксокислот может быть более одной группы оксокислот внутри молекулы. Полиоксокислоты диссоциируют на ионы постепенно, отдавая по одному протону за раз. Такая постепенная диссоциация обусловлена наличием нескольких групп оксокислот, каждая из которых может отдавать протон независимо друг от друга.
| Название кислоты | Формула | Примеры |
|---|---|---|
| Дикарбоновые кислоты | H2C2O4 | Оксаловая кислота |
| Трикарбоновые кислоты | C6H8O7 | Цитрусовая кислота |
Влияние структуры кислот на диссоциацию является важным фактором, определяющим их реакционную способность. Понимание этих особенностей помогает нам лучше понять химические свойства кислот и их участие в различных реакциях.
Научное объяснение процесса ионной диссоциации
Согласно теории Аррениуса, кислоты диссоциируют ступенчато на ионы из-за наличия электролитического диссоциативного равновесия в растворе. Когда кислота растворяется в воде, она диссоциирует на ионы в соответствии с ее реакцией с водой. Например, сильная кислота, такая как соляная кислота (HCl), полностью диссоциирует на ионы водорода (H+) и ионы хлора (Cl-).
Слабые кислоты, такие как уксусная кислота (CH3COOH), диссоциируют лишь частично. Они могут образовывать равновесие между диссоциированными и недиссоциированными молекулами. В этом случае, некоторая часть молекул останется недиссоциированной, а другая часть будет образовывать ионы водорода (H+) и ионы ацетата (CH3COO-).
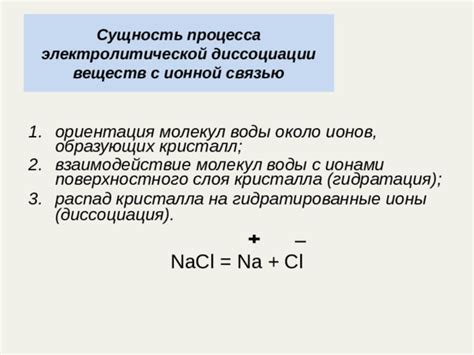
Процесс диссоциации кислот обусловлен полярностью ионных связей в кислотных молекулах. Электроотрицательные атомы, такие как кислород, образуют более сильные связи с водородом, что приводит к возникновению положительного (H+) и отрицательного (анйоны) зарядов. Эти заряды стабилизируются в воде, которая обладает полярностью благодаря своей диполярной структуре. Таким образом, ионы образуются из-за электрических сил притяжения между атомами и их электронами.
В итоге, научное объяснение ионной диссоциации основывается на диссоциативном равновесии и электростатическом притяжении между заряженными ионами. Этот процесс играет важную роль во многих химических реакциях и является основой для понимания поведения кислот и других электролитов в растворах.
Взаимодействие кислот с водой при диссоциации

Первый этап включает взаимодействие кислоты с водными молекулами. Когда молекула кислоты попадает в водное растворение, ее полярные группы, такие как карбоксильная (-COOH) или сульфоновая (-SO3H), привлекают диполярные молекулы воды (H2O) своими зарядами.
Второй этап заключается в образовании гидроксония (H3O+) и аниона кислоты. Полярные молекулы воды "разрывают" связи в молекуле кислоты, отбирая одну или более отдельных заряженных частей молекулы. Таким образом, кислота становится ионом с положительным зарядом (английское название "protonated acid"). Отщепленный от кислоты протон присоединяется к водной молекуле, образуя гидроксоний.
Третий этап представляет собой дальнейшее диссоциативное равновесие, где гидроксонии и анионы кислоты взаимодействуют друг с другом. Гидроксонии и анионы, содержащиеся в растворе, образуют равновесие, и их концентрации зависят от величины постоянной диссоциации кислоты.
Таким образом, взаимодействие кислот с водой при диссоциации приводит к образованию ионов в растворе, что является основой для объяснения ионной диссоциации кислот.