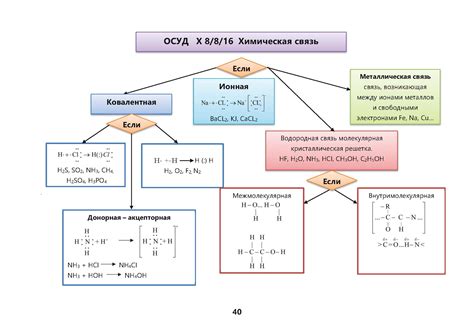
Химические соединения – это основа всего существующего в мире. Они составляют все живые организмы, землю, воздух и окружающую нас среду. Сложные структуры и вещества, которые мы видим, образуются благодаря сильным связям между атомами. Одним из основных типов химических связей является ковалентная связь, которая играет важную роль в формировании многих соединений.
Ковалентная связь возникает при обмене электронами между атомами. Атомы стремятся достичь стабильной электронной конфигурации, заполнив свою внешнюю оболочку электронами. При ковалентной связи два атома делят пару электронов, образуя таким образом общие электронные облака.
Ковалентная связь обладает рядом преимуществ, поэтому она преобладает в химических соединениях. Во-первых, она обеспечивает высокую устойчивость и прочность соединений. Атомы, связанные ковалентной связью, тесно держатся друг за другом благодаря общим электронным облакам. Это делает соединения прочными и устойчивыми в различных условиях.
Во-вторых, ковалентная связь позволяет образовывать разнообразные химические соединения. Количество электронов, которое может быть общим между атомами, ограничено только числом электронов в их внешней оболочке. Это открывает возможности для создания бесконечного множества химических соединений с различными свойствами и функциями, что является фундаментом для существования и развития различных веществ и материалов.
Преимущества ковалентной связи в химических соединениях
Ковалентная связь, являющаяся одной из основных форм химической связи, обладает рядом преимуществ перед другими видами связей в химических соединениях. Она образуется путем обмена электронами между атомами, что приводит к образованию сильной и стабильной связи.
Основные преимущества ковалентной связи в химических соединениях:
| 1. | Силовые связи | Ковалентная связь обладает высокой силой, что делает химические соединения, содержащие эту связь, стабильными и устойчивыми. |
| 2. | Химическая реакционная способность | Ковалентная связь обеспечивает высокую реакционную способность химических соединений, и это позволяет им участвовать в различных химических реакциях, образуя новые соединения и проявляя различные свойства. |
| 3. | Многообразие структур | Ковалентная связь позволяет образовывать различные структуры химических соединений, включая простейшие и сложные молекулы, полимеры, кристаллы и другие комплексные структуры. |
| 4. | Уникальные свойства | Ковалентная связь определяет уникальные физические и химические свойства химических соединений, такие как температура плавления и кипения, электропроводность, магнитные свойства и многое другое. |
| 5. | Возможность образования двойной и тройной связи | Ковалентная связь позволяет образовывать не только одиночные, но и двойные и тройные связи между атомами, что расширяет возможности для образования различных химических соединений и разнообразия структур. |
Все эти преимущества делают ковалентную связь наиболее распространенной и важной в химических соединениях, что обуславливает ее превалирование в большинстве химических реакций и образовании химических соединений.
Высокая прочность и стабильность

В результате ковалентная связь имеет высокую прочность и устойчивость. Это означает, что атомы, образующие ковалентную связь, остаются связанными вместе даже при наличии различных воздействий, таких как высокая температура, давление или внешние силы. Это делает ковалентные соединения стабильными и надежными.
Высокая прочность и стабильность ковалентной связи объясняет, почему она преобладает в химических соединениях. Ковалентные соединения могут образовывать различные структуры, включая простые молекулы, полимеры и кристаллическую решетку. Эта разнообразие структур позволяет ковалентным соединениям обладать различными физическими и химическими свойствами, делая их полезными во многих областях, включая промышленность, медицину и электронику.
Большой круг возможных соединений
Одним из главных преимуществ ковалентной связи является ее способность образовывать огромное количество различных соединений. Ковалентная связь позволяет атомам объединяться в молекулы, образуя самые разнообразные химические соединения.
Большой круг возможных соединений образуется благодаря тому, что в ковалентной связи атомы могут обменивать не только одну, но и несколько пар электронов. Это позволяет создавать различные типы связей между атомами, такие как одинарная, двойная или тройная связь.
Ковалентная связь также позволяет образовывать химические соединения между атомами разных элементов. Углерод, кислород, азот и другие элементы могут образовывать соединения друг с другом и с элементами из других групп периодической системы.
Более того, ковалентная связь позволяет создавать соединения с различными геометрическими формами. Атомы могут объединяться в линейные цепочки, кольца, трехмерные структуры и другие комплексные формы.
Таким образом, благодаря своим свойствам и возможностям, ковалентная связь преобладает в химических соединениях и образует большой круг разнообразных соединений.
| Тип связи | Примеры соединений |
|---|---|
| Одинарная связь | Молекула воды (H2O), метан (CH4) |
| Двойная связь | Этилен (C2H4), ацетилен (C2H2) |
| Тройная связь | Азот (N2), ацетилен (C2H2) |
Пластичность и гибкость структуры
Ковалентная связь, являющаяся основной формой связи в химических соединениях, обладает значительной пластичностью и гибкостью структуры. Это означает, что атомы, образующие соединение, могут с легкостью перемещаться и взаимодействовать друг с другом, образуя различные конфигурации и формы.
Пластичность и гибкость структуры ковалентных соединений обусловлены особенностями ковалентной связи. В отличие от ионных связей, где ионы привлекаются к друг другу электростатическими силами, в ковалентной связи электроны делятся между атомами. Это позволяет атомам занимать различные положения относительно друг друга и образовывать различные типы взаимодействий.
Ковалентные соединения могут обладать различными геометрическими формами, такими как линейная, плоская, пирамидальная и т. д. Эти формы определяютcя силами, действующими между атомами и электронами, которые образуют связи между ними. Пластичность и гибкость структуры ковалентных соединений позволяют адаптироваться и изменять форму под воздействием различных факторов, таких как температура и давление.
| Примеры гибких и пластичных ковалентных соединений: |
|---|
| Молекула воды (H2O) |
| Диоксид углерода (CO2) |
| Аммиак (NH3) |
Вода, например, может быть в жидком, газообразном или твердом состоянии в зависимости от температуры и давления. Это возможно благодаря способности атомов кислорода и водорода в молекуле взаимодействовать друг с другом и образовывать сильные ковалентные связи.
Гибкость и пластичность структуры ковалентных соединений играют важную роль во многих аспектах химии, таких как процессы синтеза и обработки материалов, катализ химических реакций и создание новых соединений с желаемыми свойствами.
Уникальные химические свойства

Ковалентная связь обладает рядом уникальных химических свойств, которые делают ее наиболее распространенной в химических соединениях:
- Стабильность: Ковалентная связь обладает высокой стабильностью, что делает соединения с такими связями относительно нереактивными.
- Прочность: Ковалентная связь обладает высокой прочностью, что позволяет соединениям с такими связями образовывать кристаллы и противостоять разрушению.
- Универсальность: Ковалентную связь можно образовывать между атомами разных элементов, что позволяет создавать бесконечное множество различных соединений.
- Многогранность: Ковалентная связь позволяет образовывать разные типы многогранного строения, такие как плоские молекулы, трехмерные кристаллические решетки и т.д.
- Полярность: Ковалентная связь может быть полярной или неполярной, что влияет на растворимость и химическую реактивность соединений.
- Проводимость: Ковалентные соединения могут быть как изоляторами, так и проводниками электричества, в зависимости от типа связи и структуры.



