Кристаллический хлорид натрия, известный также как обычная кухонная соль, представляет собой вещество, которое не проводит электрический ток в твердом состоянии. Хотя натрий является металлом и способен проводить электричество, его соединение с хлором, образующее хлорид натрия, атомы натрия и хлора образуют кристаллическую решетку, которая предотвращает свободное движение заряженных частиц.
Кристаллическая решетка хлорида натрия состоит из положительно заряженных ионов натрия (Na+) и отрицательно заряженных ионов хлора (Cl-). Эти ионы тесно упакованы и распределены равномерно в структуре решетки, создавая сильные электростатические связи между собой. Это приводит к тому, что ионы фактически "закрыты" в решетку и не могут свободно перемещаться, что необходимо для проведения электрического тока.
В замкнутой системе, такой как хлорид натрия, электрический ток может проходить только через свободные заряженные частицы, какими являются свободные электроны в металлических проводниках. В кристаллическом хлориде натрия эти свободные частицы отсутствуют, поэтому он не проводит электричество. Это объясняет, почему соль не может быть использована как проводник электричества в своем чистом виде.
Причины непроводимости электричества в кристаллическом хлориде натрия
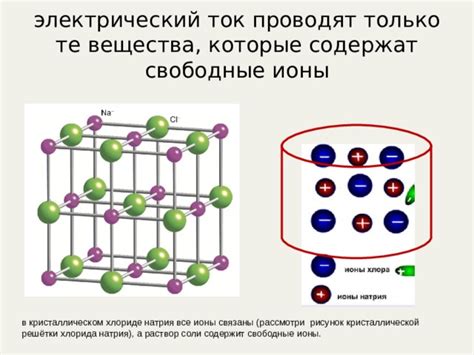
- Кристаллическая структура: Молекулы кристаллического хлорида натрия располагаются в периодической трехмерной решетке, где каждый ион окружен другими ионами аналогичного заряда. Такая упорядоченная структура препятствует свободному движению ионов и усложняет передачу электрического заряда.
- Физические свойства ионов: Ионы натрия и хлорида в кристаллическом хлориде натрия обладают большими величинами поляризуемости и энергии ионизации. Это делает их менее подвижными и затрудняет проводимость электрического тока.
- Отсутствие подвижных зарядов: В кристаллическом хлориде натрия отсутствуют свободные электроны, которые являются основной причиной проводимости в некоторых других материалах, например, в металлах. Вместо этого, передача электрического заряда в хлориде натрия осуществляется через ионную проводимость, что требует более сложной структуры ионной сетки.
В целом, эти причины объясняют непроводимость электричества в кристаллическом хлориде натрия. Однако, при нагревании или растворении в воде, кристаллическая структура разрушается, и хлорид натрия становится способным проводить электрический ток.
Структурные особенности кристаллического хлорида натрия
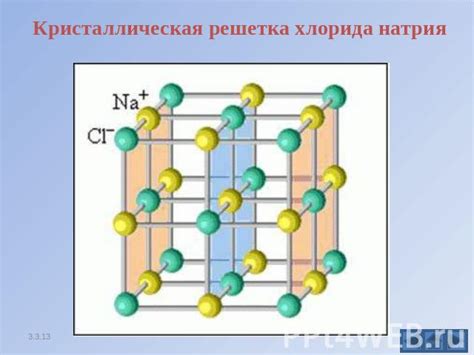
Кристаллический хлорид натрия (NaCl), или обычная кухонная соль, обладает уникальными структурными особенностями, которые связаны с его способностью не проводить электричество в твердом состоянии.
Сущность данного явления заключается в определенной организации атомов в кристаллической решетке NaCl. Каждый кристаллический хлорид натрия состоит из катионов натрия (Na+) и анионов хлорида (Cl-), которые образуют периодическую трехмерную структуру.
Особенностью этой структуры является прочная связь между ионами, образующая электрическую нейтральность кристалла в целом. Катионы натрия (Na+) занимают октаэдрическую позицию вокруг каждого аниона хлорида (Cl-). Каждый катион окружен шестью анионами и наоборот. Такая "салфеточная" структура позволяет достичь максимальной упаковки ионов в кристалле.
В результате такой структуры, электрические заряды анионов и катионов полностью компенсируются, не позволяя электронам свободно перемещаться и проводить электрический ток. То есть, кристаллический хлорид натрия не обладает свойствами проводить электричество, и является прекрасным изолятором.
Именно благодаря этим структурным особенностям, кристаллический хлорид натрия является основным компонентом соли, используемой в пищевой, медицинской и промышленной областях.



