Лакмус – это известный физический индикатор, который широко используется для определения кислотности или щелочности веществ. Когда лакмус попадает в раствор кислоты, он меняет свой цвет на красный, тем самым указывая на кислотную среду. Но почему это происходит?
Дело в том, что лакмус содержит особые вещества – лакмусовые пигменты, которые реагируют на изменение pH-значения окружающей среды. Когда лакмус погружается в раствор кислоты, происходит взаимодействие между кислотными ионами и пигментами лакмуса.
Кислоты – это вещества, которые в растворе образуют положительно заряженные ионы водорода (H+). Когда лакмус попадает в кислотный раствор, ионы водорода вступают в реакцию с пигментами лакмуса. Эта реакция приводит к изменению структуры лакмусовых пигментов, из-за чего происходит изменение цвета. Они переходят из синего состояния в красное.
Таким образом, изменение цвета лакмуса в растворе кислоты происходит из-за реакции между кислотными ионами и пигментами лакмуса. Изменение pH-значения окружающей среды ведет к изменению структуры и цвета пигментов, что позволяет определить наличие кислотности в растворе.
Феномен красноватого окрашивания лакмуса в кислой среде
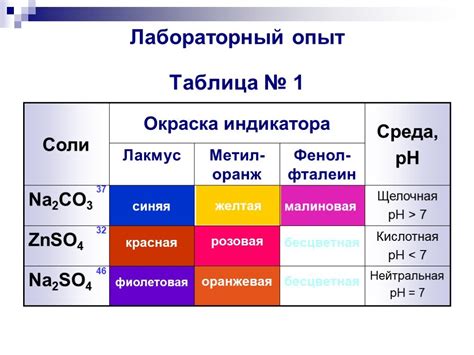
Процесс | Объяснение |
Лакмус в кислой среде | В кислой среде, количество водородных ионов (H+) превышает количество гидроксидных ионов (OH-), что приводит к изменению цвета лакмуса против кислоты. Взаимодействие между водородными ионами и лакмусом приводит к окислению пигмента и изменению его структуры. Красная окраска свидетельствует о наличии кислоты в растворе. |
Феномен красноватого окрашивания лакмуса в кислой среде широко используется не только в химических экспериментах, но и в повседневной жизни. Например, на основе этого явления можно определить кислотность пищи или питьевой воды.
Что такое лакмус и его свойства

Лакмус обладает уникальными свойствами, которые позволяют ему менять свою окраску под влиянием кислот или щелочей:
- Окислительные свойства: Лакмус окисляется в кислотной среде и приобретает красный цвет. Это связано с тем, что кислоты обладают способностью принимать электроны, что оказывает влияние на структуру и окраску лакмуса.
- Восстановительные свойства: В щелочной среде лакмус восстанавливается и становится синим. Это происходит потому, что щелочи могут передавать электроны веществам, в том числе и лакмусу, что также влияет на его окраску.
За счет этих свойств лакмус может служить показателем кислотности или щелочности растворов. Красный лакмус используется для определения щелочных или нейтральных растворов, а синий лакмус - для определения кислотных или нейтральных растворов.
Различные цветовые изменения лакмуса

Лакмус обладает свойством менять свой цвет в зависимости от pH раствора. Если раствор щелочный или нейтральный (с щелочным pH), лакмус краснеет, а в кислом растворе его цвет становится синим.
Лакмус содержит сложные органические молекулы, состоящие из единиц, называемых индикаторами. Эти индикаторы могут принимать разные формы, в зависимости от уровня pH раствора.
Когда кислый раствор взаимодействует с лакмусом, происходит обратимая реакция, при которой лакмус принимает синий цвет. Это происходит из-за того, что кислые растворы содержат больше положительных ионов водорода (H+), которые взаимодействуют с индикаторами лакмуса и приводят к изменению его цвета.
В то же время, когда раствор является щелочным или нейтральным, происходит действие обратное – лакмус окрашивается в красный цвет. Это связано с тем, что щелочные растворы содержат больше отрицательных ионов гидроксида (OH-), которые также взаимодействуют с индикаторными молекулами лакмуса, что приводит к его окрашиванию.
Красный и синий цвета лакмуса имеют различные применения. Например, при качественном анализе, когда требуется определить тип раствора (кислотный или щелочной), лакмус используется как быстрый тест-индикатор. Кроме того, изменение цвета лакмуса используется в химических исследованиях, медицине, пищевой промышленности и других областях.
Таким образом, различные цветовые изменения лакмуса являются результатом сложной химической реакции между молекулами лакмуса и ионами в растворе. Это свойство делает лакмус универсальным индикатором, используемым для определения pH раствора.
Связь красноватого окрашивания лакмуса с раствором кислоты

Лакмус имеет способность менять свой окрас в зависимости от реакции раствора. В чистой форме лакмус имеет синеватый цвет, но при контакте с кислыми растворами он краснеет, а при взаимодействии с щелочными растворами заголубливается.
Однако, химическая природа этого изменения окраски несколько сложнее. Когда лакмус попадает в раствор кислоты, происходит его окисление. Кислоты в растворе ионизируются, высвобождая положительные ионы водорода (H+). Эти ионы обмениваются с молекулами вещества лакмуса, что приводит к изменению его структуры и цвета.
Различные кислоты могут иметь различные степени окисления лакмуса. Например, сильные кислоты, такие как соляная кислота или серная кислота, полностью окисляют лакмус и вызывают интенсивное красное окрашивание. Слабые кислоты, такие как уксусная кислота, действуют менее интенсивно и вызывают более слабое красноватое окрашивание.
Интересно отметить, что лакмус не только реагирует на кислоты, но и на щелочные растворы. В растворах щелочей происходит обратная реакция - лакмус восстанавливается, и его окраска становится более синеватой. Это происходит из-за освобождения отрицательных ионов гидроксида (OH-) в результате диссоциации щелочи.
Таким образом, лакмус обладает уникальными свойствами, которые позволяют с помощью его окрашивания определять кислотность или щелочность растворов. Красноватая окраска лакмуса в растворе кислоты связана с реакцией окисления, вызванной ионами водорода, которые высвобождаются при ионизации кислоты.
| Кислота | Степень окисления лакмуса |
|---|---|
| Соляная кислота | Высокая |
| Серная кислота | Высокая |
| Уксусная кислота | Низкая |
Основные факторы, влияющие на окрашивание лакмуса

| Фактор | Описание |
|---|---|
| Кислотность или щелочность раствора | Лакмус будет краснеть в растворах с кислотными свойствами и синеть в растворах с щелочными свойствами. Это связано с изменением pH окружающей среды и взаимодействием кислот или щелочей с индикаторным веществом в лакмусе. |
| Концентрация кислоты или щелочи | Чем выше концентрация кислоты или щелочи в растворе, тем интенсивнее и быстрее будет происходить окрашивание лакмуса. |
| Время взаимодействия | Длительное или кратковременное взаимодействие лакмуса с кислотным или щелочным раствором может влиять на интенсивность окрашивания. |
| Температура | Температура раствора также может оказывать влияние на окрашивание лакмуса. Некоторые реакции могут протекать более интенсивно при определенной температуре. |
| Взаимодействие с другими веществами | Наличие других веществ в растворе может влиять на окрашивание лакмуса и приводить к изменению его цвета. Это может быть связано с химическими реакциями между индикатором и другими компонентами раствора. |
Учитывая эти факторы, можно определить кислотность или щелочность раствора с помощью лакмуса и использовать его как простой индикатор в различных химических экспериментах и анализах.
Полезные сферы применения лакмуса

- Химическая лаборатория: лакмус используется для определения кислотности или щелочности растворов. Он может быть использован в процессе исследования веществ, анализа качества продуктов, стандартизации реактивов и т.д.;
- Фармацевтическая промышленность: лакмус применяется для контроля pH в медицинских препаратах, фармацевтических растворах и косметических средствах;
- Пищевая промышленность: лакмус используется для определения уровня кислотности или щелочности в сырах, напитках и других пищевых продуктах, что помогает поддерживать правильное соотношение компонентов и обеспечивает безопасность пищевой продукции;
- Аграрная сфера: лакмусная бумага может быть использована для определения pH почвы и воды, что помогает фермерам оптимизировать условия для выращивания определенных культур и поддерживать их здоровье;
- Промышленные процессы: лакмус может быть полезен при контроле pH в процессах производства, таких как производство бумаги, текстиля, кожи, стекла и других продуктов;
- Образовательная сфера: лакмусная бумага широко используется в химическом образовании и лабораторных работах для демонстрации свойств кислот и щелочей, их реакций и использования в различных процессах.