Медь - один из самых распространенных и важных металлов в мире. Ее используют в различных отраслях промышленности, строительстве и электронике. Одной из основных причин, почему медь находит такое широкое применение, является ее устойчивость к окружающей среде.
Однако, несмотря на свою стабильность, медь может вступать в реакцию с разными веществами. Один из важных факторов, определяющих возможность реакции, - это кислотность. Большинство кислот обладают высокой реакционной способностью и способны вызывать разрушительные процессы в материалах. Но почему медь остается устойчивой в контакте с кислотами?
Причина в том, что медь обладает особой структурой и химическими свойствами, которые делают ее устойчивой к агрессивному воздействию кислот. Медная поверхность покрыта тонким слоем оксида, который перекрыт прочной пленкой купрацетата. Именно эта пленка играет ключевую роль в процессе защиты меди от коррозии и реакции с кислотами.
Физические свойства меди, обусловливающие ее невзаимодействие с кислотами

Во-первых, медь является химически стабильным металлом. Ее атомы образуют кристаллическую решетку с сильными межатомными связями, что делает медь устойчивой к деструктивному воздействию кислот. Кроме того, медь обладает низкой растворимостью во многих кислотах и, следовательно, не подвержена активной реакции с ними.
Во-вторых, поверхность меди обычно покрыта тонким слоем окиси, который образуется вследствие взаимодействия меди с кислородом из воздуха. Этот слой окиси служит некоторой защитной пленкой, предотвращающей проникновение кислот к металлу и дальнейшую химическую реакцию.
Таким образом, основными физическими свойствами меди, определяющими ее невзаимодействие с кислотами, являются ее химическая стабильность, низкая растворимость и наличие окисного слоя на поверхности. Эти свойства обусловлены особенностями строения атомов меди и взаимодействия меди с другими элементами и соединениями.
Структурные особенности кислот, препятствующие их реакции с медью
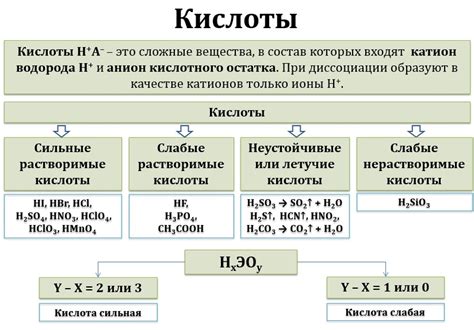
Кислоты имеют различную структуру и свойства, которые могут влиять на их реакцию с металлами, включая медь. Взаимодействие кислот с медью ограничено определенными физико-химическими особенностями.
1. Температура. Большинство кислот активнее реагируют с металлами при высоких температурах. Однако при нормальной температуре кислоты, включая сильные такие как соляная или серная, не реагируют с медью.
2. Степень окисления. Медь является переходным металлом, образует различные степени окисления. Некоторые кислоты могут реагировать с медью только при определенной степени окисления, в то время как другие не образуют активных соединений.
3. Положение в ряду активности металлов. Медь находится в ряду активности металлов между железом и серебром. Кислоты могут реагировать только с металлами, находящимися ниже них в ряду активности. Таким образом, кислоты реагируют с железом, но не реагируют с медью.
4. Плотность электрического заряда. Медь имеет высокую плотность электрического заряда в своей атомной структуре. Это делает медь малореактивной с кислотами, так как ионизация и диссоциация кислоты может происходить лишь при взаимодействии с металлом с низкой плотностью электрического заряда.
5. Защитная покрытие. Медь образует оксидное покрытие на своей поверхности, которое предотвращает дальнейшее окисление и реакцию с кислотами. Это покрытие называется патиной и играет роль естественного защитного слоя.
Из-за вышеупомянутых структурных и физико-химических особенностей, медь не реагирует с большинством кислот. Однако, некоторые кислоты, такие как азотная кислота или хлороводородная кислота, могут реагировать с медью при определенных условиях, в том числе изменении концентрации или температуры.
Роль окисления меди в создании защитной пленки

При контакте с воздухом медь окисляется, образуя оксид меди. Этот процесс можно наблюдать на поверхности медных изделий, которые со временем покрываются зеленоватым налетом, который называется патиной. Патина является результатом химической реакции меди с кислородом из воздуха.
Защитная пленка, образующаяся на поверхности меди, является очень тонкой и прочной. Она защищает металл от дальнейшего окисления и коррозии. Благодаря этой пленке, медь способна сохранять свои свойства и прочность на протяжении длительного времени. Таким образом, окисление меди является неотъемлемой частью процесса по созданию защитного слоя, который обеспечивает меди стойкость и долговечность.
Важно отметить, что окисление меди не является реакцией с кислотами. Хотя медь не реагирует с большинством кислот (за исключением некоторых агрессивных), ее окисление происходит вследствие взаимодействия с кислородом воздуха. Это делает медь не только выдающимся материалом для проводов и труб, но и защищает ее от повреждений, вызванных кислотными растворами.
Электрохимические процессы при взаимодействии меди и кислот

При взаимодействии меди с кислотами происходят электрохимические процессы, связанные с передачей электронов. Кислоты представляют собой электролиты, то есть вещества, способные проводить электрический ток.
В ходе электрохимического процесса медь может выступать в двух ролях: как анод и как катод. Когда медь действует как анод, она окисляется, отдавая электроны в электролит. В этом случае происходит растворение меди в кислоте с образованием соответствующих ионов. Когда медь действует как катод, она восстанавливается, принимая электроны от электролита.
Таким образом, электрохимические процессы при взаимодействии меди и кислот являются сложными и включают в себя процессы окисления и восстановления. Благодаря высокой устойчивости медь имеет ограниченную реакционную способность с кислотами, но в каких-то случаях все-таки может происходить некоторая реакция.
Важность учета условий и окружающей среды для понимания взаимодействия меди и кислот
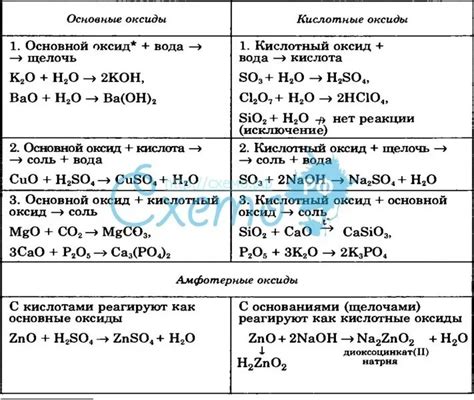
Исследования показывают, что медь не реагирует с кислотами в обычных условиях. Однако, в определенных условиях, таких как высокая температура или концентрация, медь может вступать во взаимодействие с кислотами. Также, особенности окружающей среды могут влиять на реакцию меди с кислотами.
Один из факторов, влияющих на взаимодействие меди и кислот, - это pH значения среды. Медь обычно не реагирует с кислотами в нейтральной и слабощелочной среде. Однако, в кислой среде, медь может растворяться, образуя соответствующие медные ионы.
Еще одним важным аспектом является наличие кислорода в среде. Медь может реагировать с кислородом, образуя покрытие оксида меди на поверхности меди. Это покрытие служит препятствием для продолжения реакции с кислотами, защищая медь от дальнейшего окисления и разрушения.
Также, важно учитывать концентрацию кислоты и длительность воздействия. Высокая концентрация и длительное воздействие кислоты могут вызывать коррозию меди. Но в обычных условиях, при невысокой концентрации и небольшой длительности воздействия, медь остается стабильной.
Итак, для полного понимания взаимодействия меди и кислот необходимо учитывать условия и окружающую среду. Это помогает объяснить, почему медь не реагирует с кислотами в большинстве случаев и какие факторы могут изменить это взаимодействие.



