Медь - один из наиболее распространенных металлов, используемых в различных отраслях промышленности и строительства. Она обладает высокой электропроводностью, термической и химической стойкостью. Однако, медь не реагирует с щелочью, что делает ее особенно ценной для некоторых приложений. Такое свойство меди объясняется ее химической структурой и особенностями взаимодействия с веществами в щелочной среде.
Прежде всего, следует отметить, что медь является неактивным металлом, то есть не подвержена окислению при обычных условиях, в отличие от таких металлов, как железо или алюминий. Взаимодействие меди с окружающей средой в значительной степени зависит от ее окисленного состояния.
Взаимодействие меди с щелочью связано с ее амфотерностью - способностью проявлять кислотные или щелочные свойства в зависимости от условий. В щелочной среде, щелочные ионы реагируют с поверхностью меди, образуя водорастворимые соединения, такие как гидроксид меди (Cu(OH)2).
Отсутствие реакции меди с щелочью: причины и объяснение

1. Защитная оксидная пленка: При контакте с кислородом воздуха медь образует тонкую оксидную пленку на своей поверхности. Эта пленка служит защитным барьером, предотвращающим дальнейшую реакцию меди с окружающей средой, включая щелочь. Благодаря оксидной пленке медь становится стабильной и устойчивой к реакциям.
2. Стабильность ионов меди: Ионы меди (Cu2+) имеют достаточно высокую устойчивость и не проявляют активность в щелочной среде. Эти ионы остаются неподвижными и не совершают окислительно-восстановительных реакций с щелочью.
3. Низкая растворимость меди в щелочной среде: Медь имеет низкую растворимость в щелочной среде, что ограничивает возможность реакции с щелочью. Растворимость меди повышается при повышении температуры, однако щелочь обычно применяется в комнатной температуре, поэтому реакция не происходит.
В совокупности, эти факторы объясняют отсутствие реакции меди с щелочью. Сочетание защитной оксидной пленки, стабильности ионов меди и низкой растворимости обеспечивает устойчивость меди в щелочной среде.
Химические свойства меди

1. Устойчивость к щелочам: Медь не реагирует с щелочами, такими как гидроксид натрия или гидроксид калия. Это связано с тем, что медь обладает высокой устойчивостью к основаниям и не растворяется в щелочной среде.
2. Окисление: Медь обладает способностью окисляться при контакте с воздухом. При этом на поверхности меди образуется тонкая пленка оксида, которая называется медной патиной. Она придает меди характерный зеленовато-голубой цвет. Оксидация меди является химической реакцией, которая защищает металл от дальнейшей коррозии.
3. Проводимость электричества: Медь является одним из лучших проводников электричества. Благодаря своей высокой электропроводности, медь широко используется в электротехнике и электронике.
4. Медь и вода: Медь практически нерастворима в воде. Однако, при длительном контакте с водой или другими жидкостями, содержащими воду, медь может подвергаться коррозии. Это объясняется наличием кислорода и других химически активных веществ в воде, которые способствуют растворению меди.
- Интересный факт 1: Медь имеет антибактериальные свойства и широко используется в медицине для изготовления медицинских инструментов и поверхностей.
- Интересный факт 2: Благодаря своей высокой теплопроводности, медь используется в производстве кухонных посуды и некоторых электронных компонентов, которые требуют эффективного отвода тепла.
В целом, медь – это уникальный металл с множеством интересных свойств. Сочетание устойчивости к щелочам, окисления, высокой электропроводности и других химических особенностей делает медь одним из наиболее важных и используемых металлов в различных отраслях промышленности и науки.
Классификация веществ
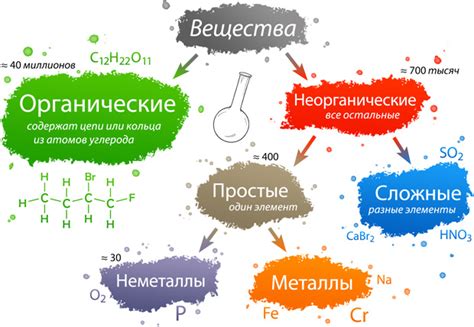
Вещества, с которыми взаимодействует медь, можно классифицировать на основе их химических свойств. В химии вещества делятся на кислоты, основания, соли и независимые вещества.
Кислоты: это вещества, у которых кислотные свойства. Они обладают способностью отдавать протоны и образовывать положительные ионы. Кислоты, как правило, реагируют с медью, образуя соли.
Основания: это вещества, у которых основные свойства. Они обладают способностью принимать протоны и образовывать отрицательные ионы. Основания также могут реагировать с медью, образуя соли.
Соли: это вещества, образованные в результате реакции между кислотой и основанием. Соли могут образовываться из реакции меди с кислотами или основаниями, но не образуются при взаимодействии меди с щелочью.
Независимые вещества: это вещества, которые не являются ни кислотами, ни основаниями, ни солями. Некоторые независимые вещества могут взаимодействовать с медью, но это зависит от их химических свойств.
Медь обладает способностью реагировать с различными веществами, но не реагирует с щелочью. Это связано с ее химическими свойствами и структурой атомов меди.
Щелочные растворы и их свойства
Первое свойство щелочных растворов - их щелочность. Они обладают высокими значениями pH, что свидетельствует о высокой концентрации гидроксид-ионов (OH-) в растворе. Эти растворы проявляют щелочные свойства, растворяя металлы с образованием гидроксидов.
Второе свойство щелочных растворов - их амфотерность. Некоторые вещества имеют способность проявлять как щелочные, так и кислотные свойства в разных условиях. Это свойство позволяет щелочным растворам реагировать как с кислотами, так и с металлами.
Третье свойство щелочных растворов - их способность образовывать соли. При реакции щелочного раствора с кислотой происходит образование соли и вода. Это происходит путем обмена протонов между кислотой и основанием. Образовавшаяся соль может быть как растворимой, так и нерастворимой.
Щелочные растворы используются в различных отраслях, таких как химическая промышленность, металлургия, пищевая промышленность и многие другие. Они непременно играют важную роль в химических реакциях и процессах, которые происходят в нашей жизни.
Что происходит при реакции
Реакция меди с щелочью не происходит из-за ее структурных особенностей. Медь, как и другие металлы группы 11 Периодической системы элементов, имеет структуру, называемую "жесткой сферой". При этом внешнее электронное облако меди образует своего рода защитный барьер, который препятствует проникновению щелочи к металлу.
Когда щелочные растворы попадают на поверхность меди, ионы гидроксида взаимодействуют с водой и образуют гидроксидную ионку (OH-), которая является основой. Однако, из-за барьера, созданного внешним электронным облаком, медь остается на своем месте и не вступает в реакцию с щелочью.
Это объясняет отсутствие меди в щелочных растворах. Тем не менее, в более концентрированных и радикальных щелочных растворах, медь может вступать в реакцию. Например, коварцитовая (гидроокись меди II) реагирует с сильными щелочами, образуя сложные соединения меди, такие как медное карбонат, гидрат меди и гидроксиды меди.
Физические свойства меди

- Медь обладает высокой электропроводностью, превосходящей многие другие металлы. Именно поэтому она используется в производстве электропроводящих кабелей и проводов.
- Медь обладает высоким теплопроводом. Это означает, что она способна быстро передавать тепло, что делает ее идеальным материалом для использования в системах отопления и кондиционирования, а также в производстве кухонной посуды.
- Медь является достаточно мягким металлом, поэтому он легко обрабатывается и формуется в различные изделия. В тоже время, медь достаточно прочна, чтобы выдерживать большие нагрузки.
- Медь обладает красивым оттенком и блеском, поэтому она широко используется в производстве ювелирных изделий.
- Медный сплав, называемый бронзой, обладает высокой стойкостью к коррозии, что делает его идеальным материалом для изготовления монет и скульптур.
Физические свойства меди делают ее очень ценным и полезным материалом, который находит применение во многих отраслях промышленности и ремесел.
Влияние окружающей среды на химическую реакцию

Окружающая среда имеет значительное влияние на химические реакции, которые происходят с различными веществами. Факторы окружающей среды, такие как температура, давление и наличие других веществ, могут изменить способ взаимодействия веществ и даже препятствовать химической реакции.
Одним из факторов, который может оказывать влияние на химическую реакцию, является pH окружающей среды. Щелочные растворы имеют высокий pH (больше 7), что означает, что они содержат больше гидроксидных ионов (OH-) в сравнении с ионами водорода (H+). Окисление меди - это реакция, которая требует наличия ионов водорода, так как при этом медь окисляется до иона меди (II). В щелочных растворах содержание ионов водорода низкое, поэтому окисление меди может замедлиться или вовсе не происходить.
Кроме того, медь является реакционно активным металлом, который способен прореагировать с кислородом воздуха, образуя покрытие оксида меди (II) на своей поверхности. Этот оксид может действовать как защитный слой, предотвращающий дальнейшую реакцию меди с окружающими веществами, включая щелочные растворы.
Таким образом, влияние окружающей среды, особенно наличие щелочных растворов, может замедлить или предотвратить реакцию меди с другими веществами. Это объясняет, почему медь не реагирует с щелочью и сохраняет свою стабильность даже при воздействии различных условий окружающей среды.