Метан – один из наиболее распространенных газов на Земле, и его большие запасы можно найти в природе. Однако, метан очень слабо растворяется в воде, и этот факт вызывает интерес ученых. Чтобы понять, почему так происходит, необходимо рассмотреть особенности взаимодействия молекул метана с молекулами воды.
Молекулы метана (CH4) состоят из одного атома углерода, связанного с четырьмя атомами водорода. Эти атомы образуют форму тетраэдра, где углерод занимает центральное положение. Такая геометрическая структура делает метан неполярным соединением, то есть не имеющим положительно или отрицательно заряженных концов.
Вода (H2O), в свою очередь, является полярным соединением, так как молекулы воды обладают постоянным отрицательным зарядом на атоме кислорода и постоянным положительным зарядом на атомах водорода. Именно эти заряды обусловлены неравномерным распределением электронной плотности в молекуле воды.
Метан и его физические свойства

У метана есть несколько характеристических физических свойств:
- Температура кипения. Метан кипит при температуре -161,5 градусов Цельсия. Это очень низкая температура, что делает метан идеальным веществом для использования в жидкостных или газовых системах, работающих при низких температурах.
- Плотность и вязкость. Метан обладает низкой плотностью и невысокой вязкостью. Это делает его легче, чем воздух, и значительно простым в использовании и транспортировке.
- Воспламеняемость. Метан является легко воспламеняемым газом, что делает его опасным в использовании в неконтролируемых условиях. Открытый огонь, искры или источники тепла могут вызвать взрывы и пожары.
- Отсутствие цвета и запаха. Метан не имеет цвета и запаха, поэтому для его обнаружения используются специальные детекторы.
Одной из особенностей метана является то, что он плохо растворяется в воде. Это связано с его молекулярной структурой и полярностью. Метан не содержит полярных групп, что делает его неполярным веществом. Вода же является полярным молекулой. Полярные молекулы легко растворяются в других полярных растворителях, но не в неполярных. Поэтому метан не растворяется в воде, но может диссоциировать в ней в виде мелких пузырьков.
Структура молекулы метана
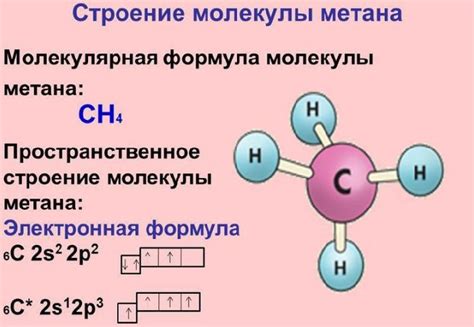
Углеродный атом занимает центральное положение в молекуле, а водородные атомы связаны с ним ковалентными связями. Каждый водородный атом образует одностороннюю связь с углеродным атомом, в результате чего молекула метана принимает тетраэдрическую форму.
| Молекула метана (CH4) | |
|---|---|
| H | C |
Такая структура молекулы метана делает ее неполярной, что не позволяет ей растворяться в воде, которая является полярным растворителем. Полярные растворители, такие как вода, взаимодействуют с полярными молекулами, образуя взаимодействия между положительно и отрицательно заряженными частями молекулы. Молекула метана не обладает такими зарядами и не может образовывать такие связи с молекулами воды.
Таким образом, из-за своей структуры молекула метана не растворяется в воде и остается неполярным веществом.
Взаимодействие метана и воды

Метан не растворяется в воде из-за своей неполярной структуры. Водные молекулы обладают полярностью из-за разницы в электроотрицательности между атомами воды. Это создает полярное поле в воде, которое позволяет ей взаимодействовать и растворять другие полярные вещества.
Однако метан, состоящий из одного атома углерода и четырех атомов водорода, не обладает полярностью. Это связано с тем, что разница в электроотрицательности между атомами углерода и водорода незначительна. В результате, метан не может образовать достаточно сильные взаимодействия с полярными водными молекулами, что препятствует его растворению в воде.
Несмотря на то, что метан не растворяется в воде, его взаимодействие с этим веществом все же имеет некоторые последствия. Например, метан может образовывать гидраты, или так называемые "снежные глыбы", в условиях высокого давления и низкой температуры. Гидраты метана являются природным источником метана и могут представлять определенную опасность, так как они обладают высокой запасной энергией и могут вызывать взрывы при физическом воздействии.
В целом, взаимодействие метана и воды является сложным и имеет множество факторов, которые влияют на его поведение и свойства. Несмотря на то, что метан не растворяется в воде из-за своей неполярной структуры, его взаимодействие с водой все же имеет важные последствия и требует учета для понимания и изучения его роли в природе и промышленности.
Молекулярная поларность метана и воды
Метан – это простейший углеводород, состоящий из одного атома углерода и четырех атомов водорода. Молекула метана является неполярной, так как все атомы водорода равноотдалены от атома углерода, и разделения зарядов нет. Это приводит к отсутствию диполя в молекуле метана.
Из-за различия в молекулярной поларности, метан плохо растворяется в воде. Водородные связи, которые являются сильными взаимодействиями водных молекул, не могут образовываться с неполярными молекулами, такими как метан. В результате, метан остается в нерастворенном состоянии в воде и образует отдельный слой на поверхности.
Важно отметить, что метан может быть растворен в некоторых других неполярных растворителях, таких как бензол или тетрахлорметан. Это связано с более сходными молекулярными свойствами метана и этих растворителей.
Физические свойства метана и воды
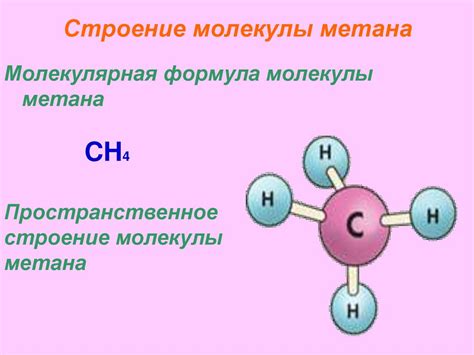
Метан обладает низкой плотностью, что делает его легче воздуха. Он плохо растворяется в воде из-за отсутствия полярных молекул. Молекулы метана состоят только из углерода и водорода, а значит, у них нет полярных атомов или групп, которые могли бы образовывать взаимодействия с полярными молекулами воды.
Вода, в свою очередь, является полярным растворителем, благодаря наличию дипольного момента. Молекула воды имеет два полярных кислородных атома, которые создают отрицательный и положительный заряды. Эти полярные атомы образуют водородные связи с другими молекулами воды и другими полярными веществами.
Из-за отсутствия полюсов, метан не образует водородные связи с водой и не взаимодействует с полярными молекулами воды. В результате, метан плохо растворяется в воде и формирует только слабое физическое взаимодействие с ней.
Именно из-за этой физической особенности метана и воды происходит низкое растворение метана в воде.
Влияние давления и температуры на растворимость метана в воде
При повышении давления метан имеет большую тенденцию растворяться в воде. Это объясняется тем, что под давлением молекулы метана сжимаются и получают возможность ближе подойти к молекулам воды, что способствует их взаимодействию и растворению. Таким образом, при повышении давления растворимость метана в воде увеличивается.
Однако температура оказывает обратное влияние на растворимость метана в воде. При повышении температуры молекулы метана приобретают большую кинетическую энергию и движутся быстрее, что снижает вероятность их взаимодействия с молекулами воды и, соответственно, растворения. Поэтому при повышении температуры растворимость метана в воде уменьшается.
Для наглядного представления влияния давления и температуры на растворимость метана в воде можно использовать таблицу:
| Давление (атм) | Температура (°C) | Растворимость метана в воде (мл/л) |
|---|---|---|
| 1 | 0 | 4,0 |
| 5 | 0 | 20,0 |
| 1 | 25 | 2,5 |
| 5 | 25 | 12,5 |
Как видно из таблицы, при повышении давления и понижении температуры растворимость метана в воде увеличивается, а при понижении давления и повышении температуры - уменьшается.
Изучение влияния давления и температуры на растворимость метана в воде имеет практическое значение, так как позволяет оптимизировать процессы добычи и транспортировки метана, а также разработать эффективные системы хранения и использования этого газа.