Молекулы - основные строительные блоки всех веществ в нашем мире. Они состоят из атомов, которые взаимодействуют между собой, образуя различные химические соединения. Но почему молекулы отталкиваются друг от друга?
Отталкивание молекул – одно из основных явлений в химии и физике. Оно определяется наличием электрических зарядов на поверхности молекул. Атомы внутри молекул имеют некоторые зафиксированные положения, но их электроны могут двигаться вокруг ядер. В результате их движения электрические заряды могут быть неравномерно распределены по поверхности молекулы. Это приводит к образованию временных дипольных моментов и разности электрических потенциалов.
Под воздействием разности электрических потенциалов молекулы начинают взаимодействовать друг с другом. Существуют два основных типа взаимодействия между молекулами: притяжение и отталкивание. Как правило, молекулы с разными разности электрических потенциалов притягиваются друг к другу, образуя силы притяжения. Однако, некоторые молекулы могут иметь такие же разности электрических потенциалов, что наблюдается отталкивание между ними.
Почему молекулы отталкиваются
Главным источником отталкивающих сил является сила Кулона, которая возникает между двумя заряженными частицами. По закону Кулона, эта сила пропорциональна произведению величин зарядов частиц и обратно пропорциональна квадрату расстояния между ними.
Когда две молекулы приближаются друг к другу, их электронные облака начинают взаимодействовать. Электронные облака молекул отталкиваются, так как они содержат отрицательно заряженные электроны. Таким образом, сила Кулона действует в направлении отталкивания и делает молекулы отталкивающими друг от друга.
Силы отталкивания между молекулами являются основой для понимания многих физических явлений, таких как отталкивание жидкостей и газов, поверхностного натяжения и диффузии. Понимание причин отталкивания молекул имеет важное значение в химии и физике и помогает объяснить многие явления и процессы, происходящие на микроуровне.
Влияние электрического заряда
Атомы состоят из заряженных частиц - электронов (-) и протонов (+). Электроны находятся на орбитах вокруг ядра атома, и их заряды отрицательные. Протоны находятся в ядре атома и имеют положительный заряд.
Когда две молекулы приближаются друг к другу, на них начинают действовать электростатические силы. Если взаимодействующие молекулы имеют одинаковый заряд (оба положительны или оба отрицательны), то между ними возникает отталкивающая электростатическая сила. Это происходит из-за того, что заряды одного знака отталкиваются.
Если же взаимодействующие молекулы имеют противоположные заряды (одна молекула положительно заряжена, а другая - отрицательно), то между ними возникает притягивающая электростатическая сила. Это объясняется тем, что заряды противоположного знака притягиваются друг к другу.
В итоге, электростатические силы между молекулами определяют их отталкивание или притяжение друг к другу. Влияние электрического заряда является одной из основных причин такого поведения молекул в пространстве.
Для наглядности можно использовать таблицу, в которой будут указаны заряды возможных комбинаций взаимодействующих молекул:
| Заряд молекулы A | Заряд молекулы B | Взаимодействие |
|---|---|---|
| Положительный (+) | Положительный (+) | Отталкивание |
| Отрицательный (-) | Отрицательный (-) | Отталкивание |
| Положительный (+) | Отрицательный (-) | Притяжение |
| Отрицательный (-) | Положительный (+) | Притяжение |
Распределение электронной плотности
В электронном облаке электроны располагаются вокруг ядра в различных энергетических уровнях и орбиталях. Орбитали представляют собой области пространства, где можно обнаружить электрон с определенной энергией. В зависимости от типа орбитали (s, p, d, f) электроны имеют разную форму, характеризующую их плотность в разных частях молекулы.
Поскольку электроны имеют отрицательный заряд, их наличие вблизи других электронов или зарядов вызывает отталкивание. Эта сила отталкивания возникает из-за репульсии зарядов и стремления электронов занять отдельные орбитали в максимально удаленных точках от других электронов и ядра. Чем более высокий энергетический уровень, тем более распределены электроны вокруг атома.
Таким образом, распределение электронной плотности в молекулярной структуре непосредственно влияет на отталкивающие силы между молекулами. Более плотная и сфокусированная плотность электронов приводит к более сильному отталкиванию и меньшей вероятности формирования связей между молекулами.
Понимание распределения электронной плотности является важным фактором при изучении физических и химических свойств молекул и взаимодействий между ними. Это помогает объяснить ряд феноменов и свойств, таких как силы отталкивания, электростатические взаимодействия и формирование химических связей.
Взаимодействие диполей

Взаимодействие молекул друг с другом определяется их электрическими свойствами. Среди таких взаимодействий особое место занимает взаимодействие диполей.
Диполь - это молекула, в которой заряды положительного и отрицательного электрического заряда находятся на некотором расстоянии друг от друга. Такое расположение зарядов в молекуле приводит к возникновению электрического дипольного момента.
Взаимодействие диполей происходит между двумя или более молекулами, каждая из которых обладает собственным дипольным моментом. Молекулы, содержащие дипольный момент, могут притягиваться или отталкиваться друг от друга в зависимости от ориентации их диполей.
Взаимодействие молекул с помощью диполь-дипольных сил является одним из важных факторов, определяющих свойства вещества. Эти силы могут приводить к образованию межмолекулярных связей и влиять на физические свойства вещества, такие как температура кипения и плавления, теплота испарения и др.
Взаимодействие диполей также играет важную роль в химических реакциях и реакциях с молекулярными соединениями. Ориентация диполей в молекулах может определять химическую активность вещества и процессы, связанные с образованием и разрывом химических связей.
Таким образом, взаимодействие диполей - это важный аспект молекулярной физики и химии, который играет решающую роль в свойствах вещества и его реакциях с другими веществами.
Эффекты кинетической энергии
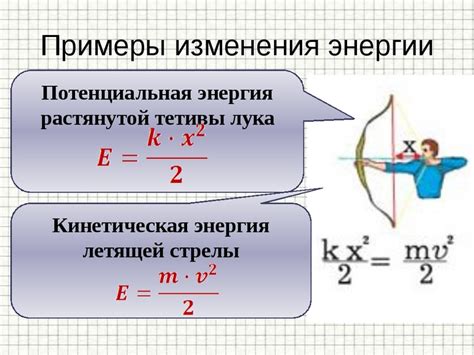
Молекулы отталкиваются друг от друга из-за кинетической энергии, которую они обладают. Кинетическая энергия связана с движением молекул и определяется их скоростью и массой.
При движении молекулы сталкиваются друг с другом и меняют направление своего движения. Это приводит к тому, что молекулы отталкиваются друг от друга и расходятся в разные стороны. Отталкивание молекул происходит из-за того, что они не могут занимать одно и то же пространство одновременно.
Кинетическая энергия также влияет на температуру вещества. При нагревании вещества, молекулы получают большую кинетическую энергию и начинают двигаться с большей скоростью. Это приводит к увеличению отталкивающих сил между молекулами и расширению вещества.
Кроме того, кинетическая энергия является причиной диффузии - процесса перемещения молекул из области с большей концентрацией в область с меньшей концентрацией. Молекулы с большей кинетической энергией могут преодолеть силы притяжения к другим молекулам и перемещаться в пространстве.
Роль водородных связей
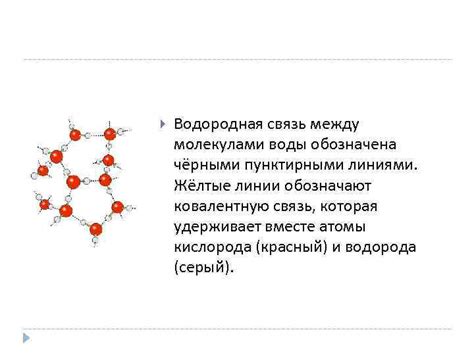
Одним из примеров водородной связи является связь между молекулами воды. Атом кислорода в молекуле воды имеет более высокую электроотрицательность, чем атомы водорода, что приводит к образованию положительного и отрицательного зарядов. В результате образуются электростатические силы притяжения между молекулами воды, которые и создают водородные связи.
Водородные связи обладают значительной силой и способны влиять на структуру и свойства многих веществ. Они могут быть ответственными за формирование трехмерной структуры белков и нуклеиновых кислот, а также за образование двойных спиралей в ДНК. Водородные связи также играют важную роль в свойствах воды, таких как ее поверхностное натяжение, высокая плотность и способность растворять множество веществ.
Влияние стерических факторов

Столкновение молекул в газах и жидкостях в значительной мере определяется стерическими факторами. Стерические факторы влияют на взаимодействие и отталкивание молекул друг от друга.
У молекул есть различные функциональные группы, атомы и связи, которые могут занимать определенное пространство. Если две молекулы находятся на расстоянии, где их функциональные группы или атомы начинают перекрываться или перекрывать другие части молекулы, то возникает стерическое отталкивание.
Стерическое отталкивание связано с объемом молекулы. Если молекулы имеют большой объем и мощную структуру, то стерическое отталкивание будет сильным. Если молекулы имеют маленький объем и компактную структуру, то стерическое отталкивание будет слабым.
Стерическое отталкивание приводит к формированию пространственных структур, таких как трехмерные сетки или наборы молекул, которые располагаются на определенном расстоянии друг от друга для снижения стерического отталкивания.
Благодаря стерическим факторам молекулы в газовой или жидкой среде стремятся занимать наиболее оптимальное пространственное расположение, чтобы минимизировать отталкивание и достичь энергетического равновесия.