Молекулы – это основные строительные блоки всех веществ в окружающем нас мире. Они обладают невероятной разнообразностью и существуют в огромном количестве форм и состояний. Однако, несмотря на свою сложность и многообразие, молекулы обычно не распадаются на отдельные атомы. Независимо от условий окружающей среды, молекулы сохраняют свою стабильность.
Молекулы получают свою стабильность благодаря сложной системе связей между атомами, которые образуют их. Атомы, в свою очередь, соединяются через электронные облака, которые образуют своего рода преграду для распада их на отдельные частицы. Эта связанность атомов – основа для образования более сложных структурных элементов, таких как молекулы и соединения.
Существует несколько механизмов, которые способствуют стабильности молекул:
1. Сильные химические связи: молекулы формируются путем образования сильных химических связей между атомами. Подобные связи требуют значительной энергии для разрушения и, следовательно, предотвращают распад молекул на атомы.
2. Энергетическая устойчивость: молекулы имеют свою собственную уровень энергии или энергетический барьер, который предотвращает их распад. Для того чтобы молекула распалась, необходимо преодолеть этот барьер, что требует значительного внешнего воздействия.
Понимание механизмов стабильности молекул является важным шагом в понимании основных принципов химии и функционирования различных веществ. Изучение этих механизмов позволяет улучшить наше понимание того, как происходят химические реакции и как синтезировать новые материалы с желаемыми свойствами. Таким образом, изучение стабильности молекул является одной из фундаментальных задач в химии, которая продолжает привлекать интерес исследователей по всему миру.
Молекулы: стабильность исходящая от механизма образования
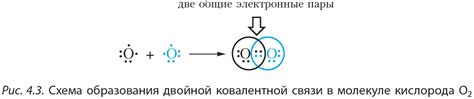
Механизм образования молекул связан с обменом электронами между атомами. Когда два или более атома соединяются, они образуют химическую связь, с помощью которой электроны становятся общими для всех атомов в молекуле. Эта общность электронов обеспечивает устойчивость молекулы и препятствует ее распаду на атомы.
Обмен электронами осуществляется по принципу совместного использования электронов атомами, чтобы достичь наиболее устойчивого состояния. В результате обмена электронами формируются химические связи, которые обеспечивают устойчивость молекулы. Кроме того, эти связи также способствуют образованию новых химических свойств и характеристик молекулы, что делает ее значительно разнообразней и полезней для различных процессов и реакций.
Таким образом, стабильность молекул и их неразрушимость на атомы определяется механизмом образования, основанным на обмене электронами между атомами. Взаимодействие атомов через общие электроны позволяет молекулам сохранять свою целостность и обеспечивает им долговечность в условиях окружающей среды.
Зависимость стабильности молекул от типа связи
Стабильность молекул определяется различными факторами, включая тип связей между атомами внутри молекулы. Тип связи может варьироваться от ковалентной до ионной, металлической или ван-дер-ваальсовой.
Ковалентные связи являются наиболее распространенным типом связей в органических и неорганических молекулах. Они образуются путем обмена или совместного использования электронов. Ковалентные связи обеспечивают стабильность и прочность молекулы, так как электроны связаны между атомами и могут быть трудно оторваны.
Полярные ковалентные связи возникают, когда один атом притягивает больше электронной плотности, чем другой, создавая разность в зарядах между атомами. Это приводит к образованию диполя и делает молекулу более стабильной.
Ионные связи образуются, когда атом отдает или принимает электроны у другого атома. В результате образуется положительный и отрицательный ионы, которые притягиваются друг к другу. Этот тип связей является очень стабильным, поскольку ионы сильно притягиваются друг к другу благодаря электростатическому эффекту.
Металлические связи образуются между атомами металлов, где электроны свободно передвигаются между атомами. Это обеспечивает высокую стабильность молекулы, так как электроны слабо связаны с отдельными атомами и могут перемещаться по всей структуре металла.
Ван-дер-ваальсовы связи являются слабыми силами притяжения между атомами и молекулами. Они возникают из-за временных изменений электронной плотности в атомах, что приводит к созданию мгновенного диполя. Молекулы, связанные ван-дер-ваальсовыми силами, могут быть менее стабильными, поскольку эти связи слабы и могут легко разойтись.
Таким образом, тип связи между атомами в молекуле существенно влияет на ее стабильность. Ковалентные и ионные связи обычно являются наиболее стабильными и сильными, в то время как металлические и ван-дер-ваальсовы связи могут быть менее стабильными.
Влияние энергетического баланса на стабильность молекул

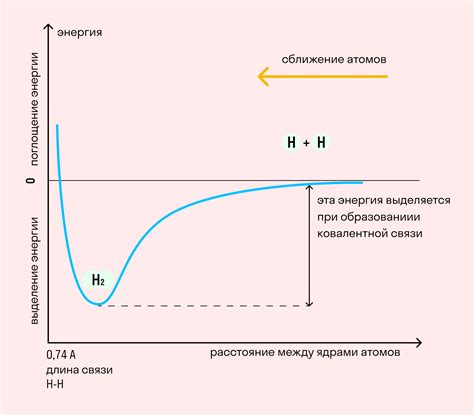
Стабильность молекул в основном обусловлена энергетическим балансом, который определяет, насколько стабильная и неподвижная будет молекула в своем состоянии.
Молекулярная стабильность зависит от энергетических уровней атомов, из которых она состоит, и способности молекулы поддерживать эти уровни. Важными факторами, влияющими на энергетический баланс и стабильность молекулы, являются электронная структура, связи между атомами и наличие различных энергетических барьеров.
Внешние факторы, такие как температура и давление, также могут оказывать влияние на энергетический баланс. Высокая температура может привести к возникновению достаточной энергии для разрушения связей и распада молекулы на атомы. Давление может изменять равновесие между различными структурными формами молекулы и влиять на ее стабильность.
Для достижения максимальной стабильности молекула стремится к состоянию минимальной энергии. Это обычно достигается путем образования ковалентных связей, которые являются более стабильными по сравнению с другими типами связей. Ковалентная связь формируется при обмене или совместном использовании электронов между атомами.
Силы внутримолекулярного взаимодействия также играют важную роль в стабильности молекулы. Эти силы могут включать в себя взаимодействия диполь-диполь, дисперсионные силы и водородные связи. Они дополняют и укрепляют образование ковалентных связей, обеспечивая дополнительную стабильность молекулы.
Таким образом, энергетический баланс является ключевым фактором в стабильности молекулы. Это обуславливает ее способность сохранять свою структуру и не распадаться на атомы. Понимание этого баланса имеет большое значение для изучения свойств и реакций молекул в различных системах и условиях.



