Молекулы - это основные строительные блоки всех веществ вокруг нас. Их поведение и взаимодействие определяют свойства и физические процессы, которые мы наблюдаем в ежедневной жизни. Однако, почему молекулы не слипаются между собой и как образуются различные структуры веществ, такие как жидкости и твердые тела? Ответ на этот вопрос кроется в межмолекулярных силах.
Межмолекулярные силы – это силы взаимодействия между молекулами, которые поддерживают их отдельность и стабильность вещества. Однако, не все молекулы взаимодействуют между собой одинаковым образом. Существует несколько типов межмолекулярных сил, каждый из которых отвечает за определенный тип взаимодействия между молекулами.
Одним из основных типов межмолекулярных сил являются дисперсионные силы, также известные как силы Ван-дер-Ваальса. Эти силы возникают из-за появления временных неравномерностей электронного облака в молекулах. В результате этих временных неравномерностей, молекулы начинают "притягиваться" друг к другу. Величина и сила этих сил зависит от массы и формы молекулы, а также от расстояния между ними.
Интересное явление молекулярного отталкивания
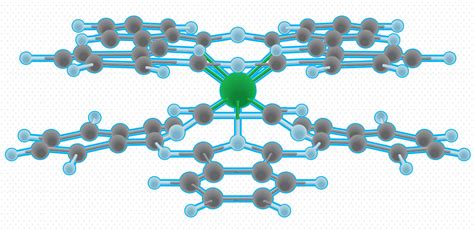
Это явление возникает из-за отрицательно заряженных электронных облаков, окружающих молекулы. Когда две молекулы вступают во взаимодействие, электронные облака сталкиваются и начинают отталкиваться. Это происходит потому, что электроны имеют отрицательный заряд и отрицательные заряды отталкиваются.
Интересно, что существуют различные силы отталкивания, которые бывают более или менее сильными в зависимости от типа молекул. Например, у молекул воды отталкивающая сила является особенно сильной, поэтому они формируют капли и пузырьки.
Молекулярное отталкивание также играет важную роль в поведении газов и жидкостей. Это явление является одной из причин, почему газы расширяются и занимают больше объема при повышении температуры. Когда газ нагревается, молекулы начинают двигаться быстрее и с большей энергией, что усиливает межмолекулярное отталкивание и повышает давление газа.
Таким образом, молекулярное отталкивание играет важную роль в мировом порядке молекул. Благодаря этому фундаментальному механизму, молекулы не слипаются между собой и сохраняют определенное пространственное расположение, обеспечивая структуру и свойства веществ.
Электростатические силы взаимодействия между молекулами
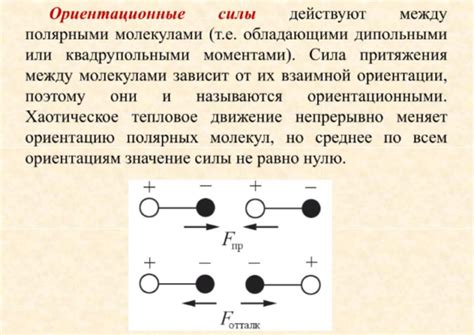
Вся материя состоит из заряженных частиц - электронов и протонов. Заряженные молекулы обладают электрическим полем, которое взаимодействует с электрическими полями других молекул.
Электростатические силы взаимодействия между молекулами могут быть притяжительными или отталкивающими. Если молекулы имеют различные заряды, то они притягиваются друг к другу. Если молекулы имеют одинаковые заряды, то они отталкиваются.
Величина электростатических сил зависит от разности зарядов молекул и их расстояния друг от друга. Чем больше разность зарядов и чем меньше расстояние между молекулами, тем сильнее воздействие электростатических сил.
Электростатические силы играют важную роль во многих физических и химических процессах. Они определяют взаимодействие между молекулами вещества и могут приводить к образованию химических связей, а также к образованию структурных и физических свойств материала.
Разница в электрических свойствах молекул определяет их поведение в различных ситуациях. Например, вода является полярной молекулой, что означает, что она имеет отрицательный и положительный заряды, расположенные на противоположных концах молекулы. Благодаря этому, молекулы воды притягиваются друг к другу электростатическими силами, образуя межмолекулярные связи и объединяясь в капли или ледяные структуры.
Таким образом, электростатические силы взаимодействия между молекулами играют важную роль в определении свойств вещества и его поведении в различных условиях.
Важность имеющихся свободных мест посредством физических сил

Молекулы, находясь в жидкости или газе, имеют возможность перемещаться независимо друг от друга. Однако, в то же время, молекулы имеют свойства притягиваться друг к другу посредством межмолекулярных сил.
Одной из таких сил является физическая сила, которая возникает между молекулами и зависит от их расстояния друг от друга. Как только молекулы находятся достаточно близко, эта сила начинает действовать и притягивает их друг к другу.
Однако, существование свободных мест между молекулами играет важную роль в сохранении разделения между ними. Именно эти свободные места являются причиной невозможности полного слипания молекул между собой.
Физические силы, разработанные согласно термодинамическим принципам, действуют прежде всего в пространстве между молекулами. При условии, что имеются свободные места между молекулами, межмолекулярные силы действуют только в пределах таких мест.
Свободное пространство между молекулами определяет величину физических сил, которые могут быть применены к ним. Благодаря существованию свободных мест, молекулы остаются разделенными и сохраняется структура вещества в жидком и газообразном состоянии.
Таким образом, важность имеющихся свободных мест заключается в том, что они позволяют молекулам сохранять свою индивидуальность и не слипаться между собой под воздействием физических сил. Это является основой для существования жидкостей и газов.
Поляризация молекул и ее влияние на межмолекулярные взаимодействия
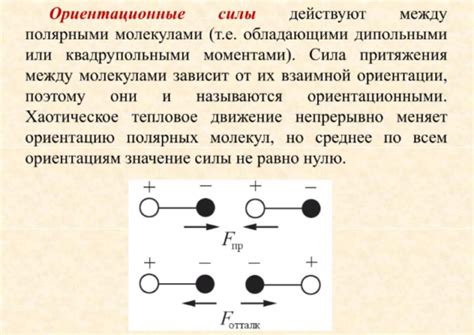
Молекулы могут обладать различными полярными свойствами, что оказывает влияние на их взаимодействие друг с другом. Поляризация молекул основана на разделении зарядов внутри молекулы, создавая так называемый дипольный момент. Дипольный момент возникает при разделении положительно и отрицательно заряженных частей молекулы, создавая временное электрическое поле вокруг нее.
Взаимодействие между поляризованными молекулами определяется силами взаимодействия между их дипольными моментами. Силы взаимодействия между поляризованными молекулами называют межмолекулярными силами. Они играют ключевую роль в формировании свойств вещества, таких как плавление, кипение, растворимость и фазовые переходы.
Межмолекулярные силы делятся на три основных типа: дисперсионные, диполь-дипольные и водородные связи. Дисперсионные силы являются наиболее слабыми и возникают в результате моментального неравномерного распределения электронной плотности в молекуле. Такие временные неравномерности могут создать мгновенные дипольные моменты, вызывая привлекательные силы между соседними молекулами.
Диполь-дипольные взаимодействия возникают между поляризованными молекулами, у которых имеются постоянные дипольные моменты. Поляризованные молекулы притягиваются друг к другу своими противоположно заряженными частями. Водородная связь – это частный случай диполь-дипольного взаимодействия, где водородная атомная связь играет роль "мостика" между молекулами и создает очень сильное взаимодействие.
Поляризация молекул и межмолекулярные взаимодействия могут быть ослаблены или усилены в зависимости от факторов, таких как температура, давление и размер молекулы. Выборчивость молекулярного взаимодействия может также зависеть от особенностей электронной структуры молекулы.
Силы сцепления и водородные связи: ключевые факторы в межмолекулярной структуре

Молекулы, находясь в жидком или газообразном состоянии, не просто свободно перемещаются, они также взаимодействуют друг с другом. Эти взаимодействия определяют межмолекулярные силы, которые играют ключевую роль в формировании и поддержании структуры вещества.
Силы сцепления между молекулами могут быть разными. Одной из наиболее сильных межмолекулярных сил являются водородные связи. Водородная связь возникает, когда водородный атом, связанный с электроотрицательным атомом (например, кислородом или азотом), притягивает к себе электроны другой молекулы. Эта связь является как своеобразным "мостиком" между молекулами и обладает высокой энергией взаимодействия.
Водородные связи являются важным фактором в структуре различных веществ. Например, вода молекулы образуют сеть водородных связей, которая обусловливает ее высокую кипящую и плавящую точки, а также свойства растворимости. Также водородные связи имеют место в белках, ДНК, РНК и других биологически активных молекулах, что определяет их структуру и функции.
Кроме водородных связей, другими важными силами сцепления между молекулами являются дисперсионные силы. Дисперсионные силы возникают вследствие временных изменений в электронных облаках атомов и молекул. В результате этих временных изменений могут ненадолго образовываться диполи и создаваться притяжение между частицами.
Общая межмолекулярная структура вещества определяется балансом между силами сцепления и силами отталкивания между молекулами. Благодаря этому балансу вещества способны сохранять свою форму и иметь свойства, такие как вязкость, плотность и температура кипения. Понимание и изучение этих сил сцепления и их влияния на структуру вещества является ключевым для понимания физических и химических свойств материи.
Дисперсионные силы и влияние ван-дер-ваальсовых взаимодействий
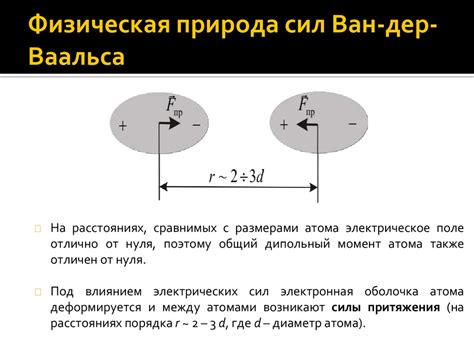
Когда две неполярные молекулы находятся рядом, их электронные облака временно деформируются под действием электростатических сил. В результате появляются мгновенные диполи, которые взаимодействуют друг с другом. Это взаимодействие называется индуцированным диполь-индуцированным диполем.
Дисперсионные силы слабее других видов взаимодействий, таких как ионные или ковалентные связи, но они все равно играют важную роль в коллективном поведении молекул. Они способствуют образованию агрегатов, таких как жидкости или твердые тела, а также влияют на физические свойства вещества, например, его температуру кипения и плавления.
Формулу для расчета дисперсионных сил впервые предложил физик Фридрих де Генн в 1873 году. Она выглядит следующим образом:
Edisp = - 1/6 * C6 / r^6 + 1/8 * C8 / r^8 + 1/10 * C10 / r^10 + ...
где Edisp - энергия дисперсии, Cn - постоянные, зависящие от вида вещества, r - расстояние между молекулами.
Вклад дисперсионных сил в силу взаимодействия между молекулами может быть рассчитан с помощью методов квантовой химии и используется в различных областях науки и техники, таких как физическая химия, материаловедение, биохимия и дизайн новых лекарственных препаратов.
Таким образом, дисперсионные силы и ван-дер-ваальсовы взаимодействия играют важную роль в определении свойств вещества и являются неотъемлемой частью химической и физической науки.
Межмолекулярные силы играют ключевую роль в поведении и свойствах веществ. Они определяют силу притяжения или отталкивания между молекулами, что влияет на их физические и химические свойства.
В зависимости от типа взаимодействия между молекулами выделяют различные виды межмолекулярных сил:
| Вид межмолекулярной силы | Описание | Примеры веществ |
| Дисперсионные силы (силы Ван-дер-Ваальса) | Силы притяжения, возникающие из-за неравномерного распределения электронов в молекуле | Метан, кислород |
| Диполь-дипольные силы | Силы притяжения, возникающие между молекулами с постоянным дипольным моментом | Вода, хлорид натрия |
| Водородные связи | Силы притяжения, возникающие между молекулами, в которых атом водорода связан с одним из электроотрицательных атомов | Вода, ДНК |
Межмолекулярные силы влияют на температуру плавления и кипения веществ, их плотность, вязкость и поверхностное натяжение. Они также определяют растворимость веществ в различных средах и их химическую активность.
Понимание роли межмолекулярных сил позволяет объяснить многие явления и свойства веществ, а также разработать новые материалы с определенными свойствами. Исследование межмолекулярных сил является важной задачей в различных научных областях, таких как физика, химия и материаловедение.