Притяжение между молекулами является основополагающим феноменом в химии и физике. Оно играет ключевую роль в формировании структуры и свойств веществ, а также во всем мире вокруг нас. Почему молекулы притягиваются и как это происходит? В этой статье мы рассмотрим основные факторы и предложим объяснение этому явлению.
Ключевым фактором, определяющим притяжение между молекулами, является силовое поле, создаваемое зарядами внутри молекулы. Эти заряды могут быть положительными или отрицательными, и их взаимное расположение определяет направление и силу притяжения. Силовое поле привлекает и удерживает молекулы друг к другу, образуя энергетически выгодные структуры.
Дополнительными ключевыми факторами, влияющими на притяжение между молекулами, являются температура и расстояние между ними. При повышении температуры молекулы приобретают большую кинетическую энергию, что снижает силу притяжения. Однако приближение молекул друг к другу сокращает расстояние между ними, что увеличивает силу притяжения. Именно благодаря балансу между температурой и расстоянием возникают разнообразные виды притяжения, такие как ван-дер-ваальсово взаимодействие, ионные связи и водородные связи.
Почему молекулы притягиваются
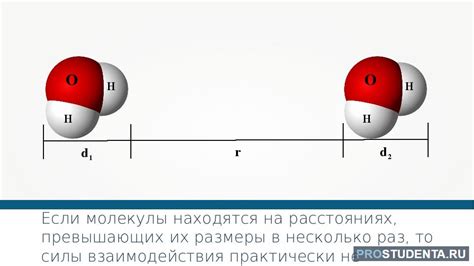
1. Электростатические силы
Одной из основных причин притяжения молекул являются электростатические силы. Атомы в молекуле содержат положительно и отрицательно заряженные частицы - протоны и электроны. Когда молекулы находятся на достаточно близком расстоянии друг от друга, заряды в этих молекулах создают электростатические поля, которые притягиваются или отталкиваются друг от друга в зависимости от полярности зарядов. Это явление создает межмолекулярные силы, которые держат молекулы вместе.
2. Дипольные взаимодействия
Другим фактором, определяющим притяжение молекул, являются дипольные взаимодействия. В некоторых молекулах электроны будут распределены неравномерно, создавая разделение зарядов и образуя электрические диполи. Такие диполи будут притягиваться и ориентироваться друг к другу, создавая дипольно-дипольные взаимодействия. Это явление особенно заметно в полярных молекулах, где заряды несимметрично расположены в пространстве.
3. Дисперсионные силы
Третьим ключевым фактором, вызывающим притяжение молекул, являются дисперсионные силы или силы Ван-дер-Ваальса. Все молекулы, независимо от их полярности, могут временно образовывать неравномерное распределение электронов, вызывающее появление межмолекулярных моментов. Эти моменты создают временные диполи, которые взаимодействуют с другими молекулами, создавая дисперсионные силы. Дисперсионные силы являются самыми слабыми силами, но они могут суммироваться при взаимодействии большого числа молекул, что приводит к стабильному притяжению.
| Фактор притяжения | Пояснение |
|---|---|
| Электростатические силы | Притяжение молекул на основе зарядов |
| Дипольные взаимодействия | Притяжение молекул на основе разделения зарядов |
| Дисперсионные силы | Притяжение молекул на основе временных диполей |
В итоге, межмолекулярные силы обусловлены различными факторами и имеют разную силу в зависимости от молекулярных свойств. Эти силы притягивают молекулы друг к другу, образуя устойчивые структуры веществ и определяя их физические и химические свойства.
Различие между электростатическим и ван-дер-ваальсовым взаимодействием
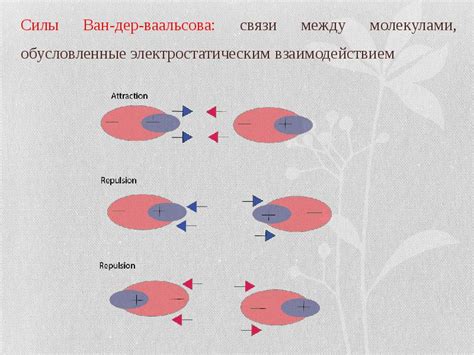
Электростатическое взаимодействие основано на притяжении или отталкивании зарядов. В молекулах заряды располагаются неравномерно и создают электрическое поле. Если молекулы имеют заряды противоположного знака, они притягиваются друг к другу. Например, положительные и отрицательные ионы притягиваются электростатическим взаимодействием. Этот тип взаимодействия сильно зависит от расстояния между молекулами и внешних условий, таких как температура и влажность окружающей среды.
Ван-дер-ваальсово взаимодействие, с другой стороны, является слабым притяжением между нейтральными молекулами. Оно основано на временных различиях в распределении электронных облаков в молекулах. В результате этих временных различий возникают моментальные диполи, которые притягивают друг друга. Это взаимодействие может носить как притягивающий, так и отталкивающий характер, и его сила зависит от множества факторов, включая размеры молекул, форму и электронную структуру.
Важно отметить, что электростатическое и ван-дер-ваальсово взаимодействие могут совместно действовать, что приводит к еще более устойчивым структурам и веществам. Как правило, более сильное электростатическое взаимодействие наблюдается в случае молекул с зарядами, в то время как ван-дер-ваальсово взаимодействие более значимо для нейтральных молекул. Однако, оба типа взаимодействия играют важную роль в химических реакциях и формировании структур.
Классификация сил притяжения между молекулами
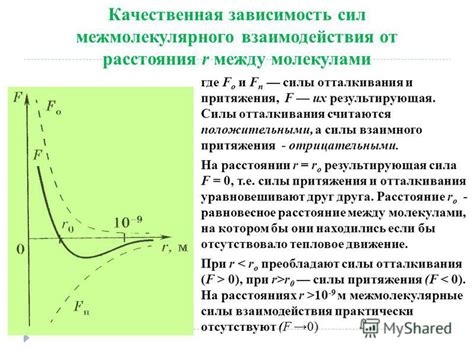
Силы притяжения между молекулами играют важную роль во многих физических и химических явлениях. Взаимодействие между молекулами определяет их свойства и поведение вещества.
Существует несколько типов сил притяжения между молекулами:
- Дисперсионные силы (силы Лондоновского типа): это слабые силы притяжения, вызванные временным возникновением положительного и отрицательного зарядов на поверхности молекул. Данный тип сил притяжения присутствует у всех молекул и является основным фактором, определяющим притяжение неполярных молекул.
- Диполь-дипольные силы: эти силы притяжения возникают между полярными молекулами и обусловлены существованием дипольных моментов внутри молекулы. Они более сильны, чем дисперсионные силы, и играют важную роль в свойствах веществ, таких как температура плавления и кипения.
- Водородная связь: это особый тип сил притяжения, возникающий в тех случаях, когда водородный атом, связанный с электроотрицательным атомом (как правило, кислород, азот или фтор), вступает во взаимодействие с электроотрицательным атомом соседней молекулы. Водородная связь является одной из сильнейших сил притяжения, и ее наличие может существенно изменять свойства вещества.
- Ионно-дипольные силы: эти силы притяжения возникают между ионами и полярными молекулами. Ионно-дипольные силы играют важную роль в свойствах растворов, так как они обуславливают растворимость и ионную проводимость между растворами и веществами.
Понимание типов сил притяжения между молекулами является важным шагом в изучении физических и химических свойств веществ и позволяет более глубоко понять и объяснить их поведение и взаимодействие в различных условиях.
Термодинамическое объяснение притяжения

Одним из ключевых факторов, определяющих притяжение между молекулами, является энтропия системы. Энтропия – это мера беспорядка или неупорядоченности системы. В случае молекулярных взаимодействий, притяжение между молекулами может увеличить упорядоченность системы, что приводит к снижению энтропии. По принципу минимума энтропии, система стремится к состоянию с наименьшей энтропией, что приводит к притяжению между молекулами.
Еще одним фактором, влияющим на притяжение между молекулами, является изменение энергии системы. Притяжение между молекулами может приводить к снижению энергии системы, что является энергетически выгодным. По принципу минимума энергии, система стремится к состоянию с наименьшей энергией, что повышает притяжение между молекулами.
Также важным фактором является равновесие между притяжением и отталкиванием между молекулами. В случае притягивающих молекул, силы притяжения преобладают над силами отталкивания, что приводит к образованию стабильных связей между молекулами. Это объясняет почему молекулы веществ могут оставаться в состоянии жидкости или твердого тела, где притяжение между молекулами достаточно сильно, чтобы преодолеть силы отталкивания.
С другой стороны, в случае отталкивающих молекул, силы отталкивания превышают силы притяжения, что приводит к разобщению молекул и увеличению энтропии системы.
| Фактор | Описание |
|---|---|
| Энтропия | Притяжение между молекулами может приводить к снижению энтропии системы. |
| Энергия | Притяжение между молекулами может приводить к снижению энергии системы. |
| Равновесие сил | Силы притяжения должны преобладать над силами отталкивания для образования стабильных связей. |
Практическое применение молекулярного притяжения

Одним из практических применений молекулярного притяжения является клей. Молекулярные силы притяжения между молекулами клея позволяют ему эффективно скреплять различные материалы вместе. Это может быть использовано в производстве мебели, автомобилей, электроники и других отраслях промышленности.
Молекулярное притяжение также играет важную роль в фармацевтической и медицинской промышленности. Многие лекарственные препараты основаны на взаимодействии молекул с определенными рецепторами или ферментами в организме. Молекулярные силы притяжения между молекулами лекарственных веществ и рецепторами могут способствовать эффективному воздействию на болезни и их лечению.
Кроме того, молекулярное притяжение играет важную роль в биологии, например, в процессе клеточного распознавания и связывания. Молекулярные силы притяжения между белками и другими молекулами могут участвовать в формировании структур клеток и взаимодействии с окружающей средой.
Еще одним примером практического применения молекулярного притяжения является техника селективной адсорбции. Молекулярные силы притяжения могут использоваться для разделения смесей веществ, например, в процессе очистки воды или в процессе извлечения определенных компонентов из растворов.
Таким образом, молекулярное притяжение имеет широкое практическое применение и играет важную роль в различных отраслях науки и технологии. Изучение и понимание этого явления позволяет разрабатывать новые материалы, лекарственные препараты и технологии, что вносит значительный вклад в развитие общества и улучшение качества жизни людей.



