Молекулы - основные строительные блоки всего материального мира. Их взаимодействие является фундаментальной составляющей химических и физических процессов, определяющих строение и свойства веществ. Но что заставляет молекулы притягиваться или отталкиваться друг от друга?
Основной причиной взаимодействия молекул являются электрические силы. Внутри каждой молекулы электроны и ядра атомов взаимодействуют между собой с помощью электромагнитных сил. Но когда две или более молекулы находятся вблизи друг друга, возникают дополнительные электростатические взаимодействия, влияющие на их поведение и структуру.
Взаимодействие молекул может быть притягивающим или отталкивающим. Когда молекулы притягиваются друг к другу, они формируют межмолекулярные взаимодействия, такие как водородные связи, дисперсные силы ван-дер-ваальса и ионные связи. Эти взаимодействия могут быть слабыми или сильными, что влияет на свойства вещества.
Почему молекулы взаимодействуют друг с другом?

Основными причинами взаимодействия молекул являются электростатические силы и магнитные силы.
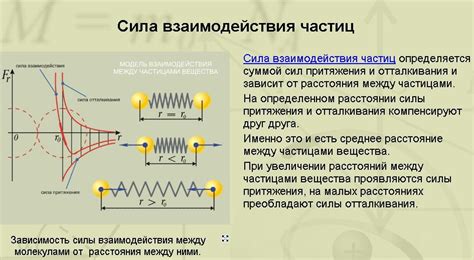
- Электростатические силы: Все молекулы состоят из положительных и отрицательных зарядов. Из-за этих зарядов возникают электростатические силы притяжения или отталкивания между молекулами. Если заряды разных знаков, молекулы притягиваются друг к другу. Если заряды одинаковые, они отталкиваются.
- Магнитные силы: Некоторые молекулы обладают магнитными свойствами и могут взаимодействовать друг с другом посредством магнитных сил. Это происходит из-за наличия магнитных диполей в молекулах, которые притягивают или отталкиваются друг от друга в зависимости от ориентации диполей.
Помимо электростатических и магнитных сил, молекулы также взаимодействуют посредством других сил:
- Ван-дер-Ваальсовы силы: Это слабые притяжения между электрическими диполями, индуцированными электрическим полем другой молекулы. Эти силы являются причиной взаимодействия молекул в газах и жидкостях и помогают им образовывать агрегатные состояния.
- Ковалентные связи: В некоторых случаях, молекулы могут образовывать ковалентные связи, обменяв электроны между собой. Это крепкие связи, которые удерживают атомы в молекуле и определяют ее форму и свойства.
Таким образом, взаимодействие молекул обусловлено различными силами, включая электростатические, магнитные, ван-дер-Ваальсовы и ковалентные связи. Этот процесс играет ключевую роль в множестве физических и химических явлений и позволяет образовывать различные структуры веществ.
Причины взаимодействия молекул

Основной причиной взаимодействия молекул являются силы притяжения. Внутри атомов и молекул действуют электростатические силы, возникающие из-за различия зарядов. Например, положительный заряд ядра атома притягивает отрицательно заряженные электроны. Атомы могут образовывать связи, в результате чего их электронные облака перекрываются, образуя область с более высокой плотностью заряда.
Кроме электростатических сил, существуют и другие причины взаимодействия молекул. Одной из них является термодинамическая нестабильность. Молекулы стремятся минимизировать свою энергию, и для этого они могут обмениваться энергией или частицами с окружающими молекулами. Такие взаимодействия могут приводить к образованию новых связей, изменению конформации молекулы и другим химическим реакциям.
Другим важным фактором, влияющим на взаимодействие молекул, является геометрия. Когда молекулы находятся близко друг к другу, их формы и ориентации становятся важными. Молекулы могут взаимодействовать через различные типы взаимодействий, такие как водородная связь, ионно-дипольное взаимодействие, ван-дер-ваальсовы силы и другие. Форма молекулы и расположение ее функциональных групп могут определять типы возможных взаимодействий и их силу.
Таким образом, взаимодействие между молекулами обусловлено силами притяжения, термодинамической нестабильностью и геометрией молекулы. Понимание этих причин и механизмов взаимодействия молекул позволяет лучше понять основные законы химических и физических процессов и применить эту информацию в различных областях науки и технологий.
Механизмы взаимодействия молекул
Основными механизмами взаимодействия молекул являются:
| 1. Ковалентная связь | – это сильное взаимодействие между атомами, при котором они обменивают электроны и образуют совместно используемые энергетически более выгодные уровни. Ковалентная связь является наиболее прочным типом взаимодействия и обуславливает формирование молекул и сетей веществ. |
| 2. Ионная связь | – это взаимодействие между атомами, в результате которого один атом отдает электроны, а другой атом принимает их. Образующиеся ионы притягиваются друг к другу благодаря разнице зарядов и образуют ионные связи. Ионная связь характерна для соединений, состоящих из металлов и неметаллов. |
| 3. Ван-дер-Ваальсовы силы | – это слабые силы притяжения между молекулами, которые возникают благодаря временным изменениям электронной оболочки. Ван-дер-Ваальсовы силы являются наиболее слабым типом взаимодействия, однако они играют важную роль в многочисленных физических и химических явлениях. |
| 4. Водородные связи | – это особый тип взаимодействия между атомами водорода и атомами других элементов, таких как кислород, азот или фтор. Водородные связи являются сильными и способствуют формированию молекул воды и многих других веществ. |
Каждый из указанных механизмов взаимодействия молекул имеет свои характерные особенности и влияет на их физические и химические свойства. Взаимодействие молекул особенно важно для понимания свойств и поведения веществ, а также для развития новых материалов и технологий.