Атом состоит из ядра и облака электронов. Каждый электрон обладает своим определенным энергетическим состоянием, которое можно описать с помощью квантовых чисел. В атоме электроны распределяются по энергетическим уровням и подуровням, которые в свою очередь имеют ограниченное число мест для электронов.
P-подуровень является одним из уровней энергии атома, на котором максимальное число электронов равно 6. Это связано с особенностями квантовой механики и принципом заполнения энергетических уровней. Каждый подуровень состоит из пяти орбиталей, на которых могут находиться электроны.
В соответствии с правилами заполнения уровней, на первые 4 орбитали подуровня p размещаются 2 электрона. Это связано с тем, что на каждой орбитали могут находиться только 2 электрона с противоположными спинами (по принципу Паули). На пятой орбитали располагается оставшееся 2 электрона, что в сумме дает максимальное число электронов на p подуровне - 6.
Такое ограничение на максимальное число электронов на p подуровне обусловлено принципом заполнения уровней, который соблюдается в атомах всех элементов. Понимание этого особенного правила взаимодействия электронов в атоме позволяет более глубоко изучить химические свойства элементов и их соединений, а также понять причины многих физических и химических явлений.
Различные энергетические уровни электронов
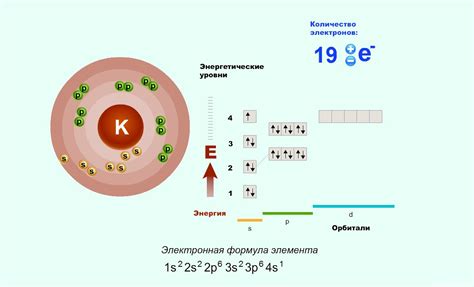
Атомы состоят из электронов, негативно заряженных частиц, которые обращаются вокруг ядра. Каждый электрон занимает определенное энергетическое состояние, которое определяется его энергетическим уровнем. Уровни энергии, на которых могут находиться электроны в атоме, разделены на энергетические подуровни.
Наиболее низкий энергетический уровень называется уровнем 1, затем идут уровни 2, 3, 4 и так далее. Каждый уровень содержит один или более подуровней, обозначаемых буквами: s, p, d, f и т.д. Подуровни различаются по форме и размерам орбиталей, областям пространства, где можно найти электрон.
Подуровень p состоит из трех орбиталей, обозначаемых px, py и pz. Каждая орбиталь может содержать максимум 2 электрона, что означает, что общее число электронов на подуровне p равно 6 (2 на каждую орбиталь).
Ограничение на количество электронов на подуровне p объясняется принципом заполнения электронных орбиталей. Согласно этому принципу, электроны заполняют орбитали по возрастанию их энергии. Подуровень p имеет три орбитали, поэтому он может вместить только 6 электронов.
Распределение электронов по энегретическим уровням и подуровням играет ключевую роль в определении химических свойств и поведения атомов.
Описание p подуровня
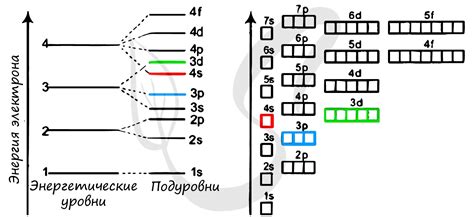
Максимальное число электронов на подуровне p равно 6. Это связано с тем, что каждая орбиталь может содержать только два электрона с противоположным спином. Следовательно, суммарное количество электронов на подуровне p будет равно 2 (орбиталь 1) + 2 (орбиталь 2) + 2 (орбиталь 3) = 6.
Подуровень p играет важную роль в определении химических свойств элементов. Наличие или отсутствие электронов на этом подуровне может определять степень реактивности и периодичность элементов. Кроме того, подуровень p также влияет на способность атома образовывать химические связи и формировать различные структуры соединений.
Важно отметить, что наиболее энергетически выгодным состоянием для атома является заполненный подуровень p с максимальным числом электронов, так как это состояние обеспечивает наиболее стабильную конфигурацию электронов.
| Орбиталь | Магнитное квантовое число (m) |
|---|---|
| p-орбиталь 1 | -1 |
| p-орбиталь 2 | 0 |
| p-орбиталь 3 | 1 |
Правило Хаунда
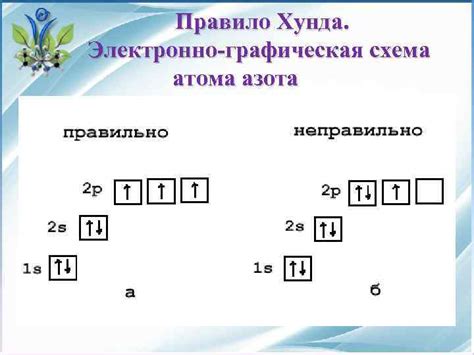
Максимальное число электронов на p подуровне влияет на строение и свойства атомов. Благодаря этому правилу возникают определенные закономерности в расположении элементов в периодической таблице Менделеева и их химическом поведении.
Применяя правило Хаунда, можно предсказать общее количество электронов на p подуровне и использовать его для проведения химических расчетов и понимания взаимодействия атомов.
Популяция электронами p подуровня
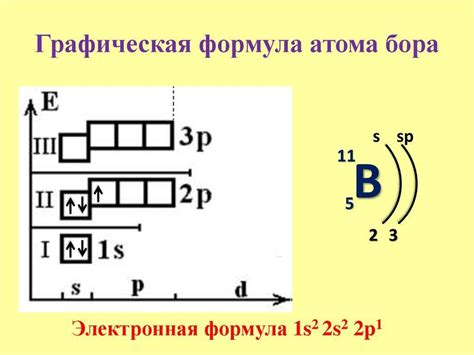
Подуровень p состоит из трех орбиталей: px, py и pz. Каждая орбиталь может вместить по два электрона в соответствии с принципом Паули. Таким образом, суммарно каждая орбиталь p подуровня может содержать максимум 2 электрона, а все три орбитали вместе могут содержать максимум 6 электронов.
Электроны в p подуровне заполняют орбитали по принципу наименьшей энергии. Сначала заполняются орбитали с наименьшей энергией, а затем с более высокой. Когда все орбитали p подуровня заполнены, дополнительные электроны будут размещены на следующем подуровне.
Понимание максимальной популяции электронами на p подуровне позволяет нам лучше понять структуру атома и его электронную конфигурацию. Знание этой информации особенно важно при изучении химических свойств элементов и их реакций.
Объяснение максимального числа электронов на p подуровне

Электронные уровни атома могут разделяться на подуровни, которые обозначаются буквами s, p, d, f. Каждый подуровень состоит из определенного числа орбиталей, а орбитали в свою очередь могут содержать пары электронов.
На p подуровне может быть размещено максимальное число 6 электронов. Это связано с тем, что p-подуровень имеет три орбитали, обозначаемые как px, py и pz. Каждая орбиталь p-подуровня может содержать два электрона с противоположным спином, что в сумме дает нам 6 электронов.
Уровень заполнения орбиталей электронами осуществляется в соответствии с принципом соблюдения правил Гунда и правил сложения - сначала заполняются орбитали с меньшей энергией. Поэтому на p подуровне сначала заполняются орбитали px, py и pz, прежде чем электроны начинают заполнять следующий подуровень.
Максимальное число электронов на p подуровне, равное 6, обусловлено структурой электронных орбиталей и правилами заполнения электронами орбиталей, которые определяют, как электроны могут распределяться на энергетических уровнях атома.
Примеры элементов с полностью заполненным p подуровнем

В п-подуровне максимальное число электронов равно 6. Это означает, что в p-подуровне нет ни одного свободного места для дополнительных электронов.
Примеры элементов с полностью заполненным p-подуровнем:
| Элемент | Атомный номер |
|---|---|
| N | 7 |
| P | 15 |
| As | 33 |
| Sb | 51 |
| Bi | 83 |
Элементы с полностью заполненным p-подуровнем обладают особенностями в своей химической активности и их свойства часто отличаются от элементов, у которых p-подуровень не полностью заполнен.



