Электролиты - это вещества, способные в растворе разлагаться на ионы и обеспечивать проводимость электрического тока. В то время как некоторые растворы могут быть электролитами и проводить электричество, раствор сахара не обладает такой способностью. Это вызывает любопытство: каким образом одно вещество может быть электролитом, а другое - нет?
Причина, по которой раствор сахара не является электролитом, кроется в его молекулярной структуре. Молекулы сахара обладают ковалентной связью, которая удерживает атомы вместе. В результате, раствор сахара состоит из неделимых молекул, не разделяющихся на ионы при диссоциации в воде.
В то время как электролитные растворы содержат ионы, которые независимо движутся в растворе, молекулы сахара не образуют отдельных заряженных частиц. Это означает, что при проведении электрического тока через раствор сахара, электроны не могут свободно передвигаться между частями раствора, и ток не проходит через него. Раствор сахара обладает терминальной проводимостью, так как имеет некоторую электропроводность, но он не может рассматриваться как электролит.
Причины, почему раствор сахара не электролит
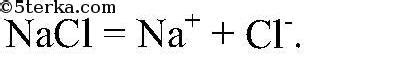
Сахар, или сахароза, является сложным углеводом, состоящим из молекул глюкозы и фруктозы. При растворении в воде каждая молекула сахара разделяется на свои составные части, но они остаются неразделенными и не образуют ионные частицы.
Вода, в свою очередь, является полярным растворителем, то есть молекулы воды обладают положительным и отрицательным зарядом. Взаимодействие молекул сахара и молекул воды происходит путем образования водородных связей. Молекулы сахара вступают в слабое притяжение с молекулами воды, но не разделяются на ионы.
Таким образом, раствор сахара не образует свободных ионов, которые могли бы проводить электрический ток. Однако это не означает, что сахарный раствор является непроводящим раствором. Вода, содержащая растворенный сахар, может незначительно проводить электрический ток благодаря водородным связям и наличию ионов других веществ, находящихся в воде или между самими молекулами сахара.
Важно отметить, что растворимость сахара в воде зависит от температуры и концентрации сахара. Более концентрированные растворы сахара имеют более высокую электропроводность.
Отсутствие ионов сахара

В то время как некоторые вещества, такие как соли и кислоты, разделяются на ионы в растворе и способны проводить электрический ток, молекулы сахара не обладают такой способностью. Сахар представляет собой органическое соединение, состоящее из углерода, водорода и кислорода, и его молекула является нейтральной и не диссоциирует на ионы.
При растворении сахара в воде, его молекулы окружаются молекулами воды, образуя гидратированные комплексы. В этом случае сахар распадается на частицы сахарозы (C12H22O11), которые не являются ионами и не могут проводить электрический ток в растворе.
Таким образом, отсутствие ионов сахара в растворе является причиной того, что раствор сахара не является электролитом.
Молекулярное строение сахара
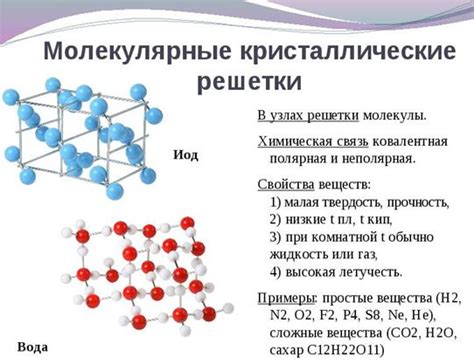
Наиболее распространенным моносахаридом является глюкоза, которая является основным источником энергии для организмов. Глюкоза и другие моносахариды имеют кольцевую структуру. Кольцевая форма моносахаридов образуется при взаимодействии гидроксильной группы с кетоновой или альдегидной группой того же молекулярного фрагмента.
Молекула сахара может содержать одну или несколько гидроксильных групп, которые могут быть замещены атомами других элементов, таких как азот или фосфор. Эти замещения могут влиять на свойства сахара, включая его растворимость и способность быть электролитом.
Но в отличие от других электролитов, таких как соль или кислота, сахар не диссоциирует в растворе на ионы. Вместо этого молекулы сахара остаются неделимыми и не образуют заряженных частиц. Это обусловлено отсутствием в молекуле сахара заряженных элементов, которые могли бы взаимодействовать с водой и образовывать ионы.
Именно поэтому раствор сахара не проводит электрический ток и не является электролитом, в отличие от растворов солей и кислот, которые диссоциируются на ионы и способны проводить электрический ток.
Полярность молекулы сахара
Молекула сахара состоит из атомов углерода, кислорода и водорода, связанных между собой. Между атомами в молекуле сахара происходят различные химические связи, которые придают этому соединению определенную форму и структуру. Эти связи делают молекулу сахара полюсной.
Водородные связи образуются между атомом кислорода в молекуле сахара и атомами воды. Это происходит из-за притяжения положительно заряженных атомов воды к отрицательно заряженному кислороду в молекуле сахара.
Таким образом, полярность молекулы сахара позволяет ей взаимодействовать с молекулами воды, образуя раствор. Однако, в сахарном растворе водородные связи образуются только между сахарными молекулами и молекулами воды, а не между свободными ионами, как это происходит в случае с растворимыми солями. Поэтому, сахарный раствор не проводит электрический ток и не является электролитом.
Отличие раствора сахара от электролитических растворов
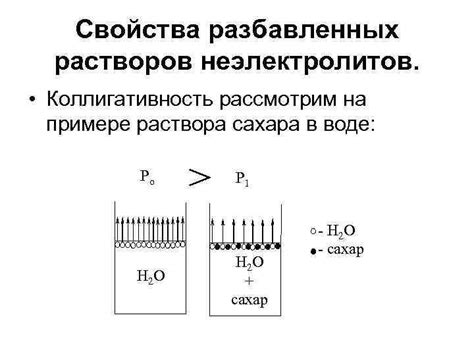
Растворы сахара и электролитические растворы обладают разными свойствами и химическими составами, что приводит к их отличиям:
Электролиты vs. нэлектролиты: Основное отличие между раствором сахара и электролитическим раствором заключается в их способности проводить электрический ток. Растворы сахара являются нэлектролитами, то есть они не разделяются на ионы и не проводят электрический ток в растворе. В то время как электролитические растворы содержат в себе электролиты, которые диссоциируются на ионы и способны проводить электрический ток.
Видимый эффект: В электролитических растворах, из-за наличия диссоциировавших ионов, образуются эффекты, такие как проводимость электрического тока, электролиз, ионопроводность и другие. В то время как в растворе сахара отсутствуют такие эффекты, поскольку сахар молекулярного вида и не разделяется на ионы.
Молекулярный состав: Растворы сахара состоят из молекул сахара, которые, не являясь ионами, перемешиваются с молекулами растворителя, образуя раствор. Такие растворы не содержат частиц электролитов и ионов. В отличие от этого, электролитические растворы содержат в себе химические вещества, способные образовывать ионы при растворении.
Если учесть эти отличия, становится понятно, почему раствор сахара не является электролитом и не обладает электролитическими свойствами электролитических растворов.



