Каждое вещество в мире обладает уникальным набором свойств, которые делают его уникальным и отличным от других веществ. Эти свойства определяют, как вещество взаимодействует с другими веществами, как оно изменяется под воздействием различных условий и какие физические и химические свойства оно обладает.
Причина, по которой разные вещества имеют различные свойства, заключается в их молекулярной структуре. Молекулы каждого вещества состоят из атомов, которые соединены определенным образом. Эта структура определяет, какие силы действуют между атомами и как они взаимодействуют друг с другом.
Некоторые вещества, такие как металлы, обладают свободно движущимися электронами, которые создают электрические и тепловые проводимости. Другие вещества, такие как вода, образуют водородные связи между молекулами, что придает им способность образовывать воду и иметь высокое кипящую точку.
Физические и химические свойства вещества также зависят от его состояния – твердого, жидкого или газообразного. Это состояние определяется интра- и межмолекулярными силами, которые действуют на вещество и определяют его структуру и упаковку.
Физические свойства веществ
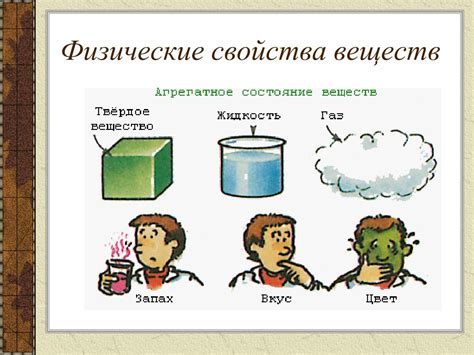
Эти свойства включают:
| Термические свойства | Являются важными для понимания изменения температурных характеристик вещества, таких как плавление, кипение и теплопроводность. |
| Электрические свойства | Описывают поведение вещества под воздействием электрического поля, включая его проводимость и диэлектрическую проницаемость. |
| Оптические свойства | Изучают взаимодействие вещества с электромагнитным излучением, включая преломление, поглощение и рассеяние света. |
| Механические свойства | Описывают поведение вещества под действием приложенных сил, включая его прочность, упругость и вязкость. |
| Распределение свойств по состояниям | Каждое вещество может находиться в трех состояниях - твердом, жидком или газообразном. Каждое состояние имеет свои уникальные физические свойства. |
Изучение физических свойств веществ позволяет углубленно понять их поведение в различных условиях и является важной основой для различных областей науки и техники.
Зависимость от химического состава

Различные вещества имеют различные свойства в основном из-за их химического состава. Химические элементы, из которых состоят вещества, определяют их структуру и свойства. Взаимодействие между атомами и молекулами вещества определяет его физические и химические свойства, такие как температура плавления, скорость реакций, электропроводность и т.д.
Таблица химических элементов и их химических свойств помогает установить зависимость между составом вещества и его свойствами. Например, металлы обычно обладают высокой электропроводностью из-за своей электронной структуры, которая позволяет электронам свободно перемещаться веществе. В то же время, неметаллы имеют обычно более низкую электропроводность из-за того, что их электронная структура не позволяет электронам свободно перемещаться.
Химический состав вещества также может изменять его физические свойства, такие как плотность, твердость и т.д. Например, добавление металлических примесей может повысить твердость материала. Изменение химического состава также может привести к изменению химических свойств вещества, например, его способности вступать в химические реакции или растворяться в других веществах.
Таким образом, химический состав играет важную роль в определении свойств вещества. Понимание этой зависимости позволяет ученым разрабатывать новые материалы с определенными свойствами и применение их в различных отраслях науки и техники.
Влияние молекулярной структуры

Молекулярная структура вещества играет важную роль в определении его свойств. Каждое вещество состоит из молекул, которые могут быть органическими или неорганическими.
Органические молекулы содержат углерод атомы и играют важную роль в биологии и химии жизни. Например, аминокислоты, из которых состоят белки, имеют сложные трехмерные структуры, что позволяет им выполнять различные функции в организме.
Неорганические молекулы, такие как соли и металлы, обычно имеют более простую структуру. Они не содержат углерод атомы и могут образовывать кристаллические решетки или простые молекулы.
Молекулярная структура также определяет физические свойства вещества. Например, молекулы, имеющие положительные и отрицательные заряды, могут образовывать ионные связи, которые делают вещество твердым и хрупким. Другие вещества могут образовывать ковалентные связи, где электроны общие между атомами, что делает вещество более гибким и пластичным.
Также молекулярная структура влияет на химические свойства вещества. Реакционная активность вещества зависит от того, какие функциональные группы присутствуют в его молекулярной структуре. Например, алканы мало реакционноспособны, алкены имеют двойные связи и могут участвовать в реакциях аддиции, а карбонильные соединения могут образовывать альдегиды, кетоны и другие функциональные группы.
- Молекулярная структура определяет физические и химические свойства вещества.
- Органические молекулы содержат углерод атомы и играют важную роль в биологии.
- Неорганические молекулы обычно имеют более простую структуру.
- Молекулярная структура влияет на реакционную активность вещества.
Формирование кристаллической решетки
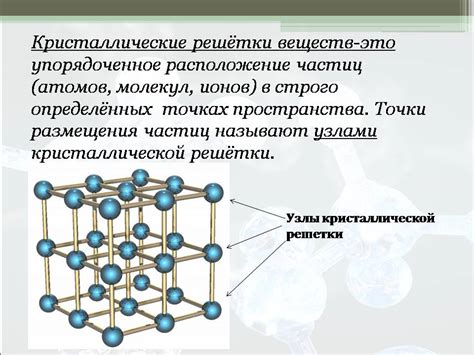
Процесс формирования кристаллической решетки начинается с расположения атомов или молекул вещества в пространстве. При этом они стремятся занять наиболее устойчивое положение, минимизируя энергию системы. Результатом этого процесса является образование регулярной, повторяющейся структуры, состоящей из однотипных элементов - вершин, рёбер и граней.
Кристаллическая решетка может быть трёхмерной или двумерной, а также иметь различные формы, такие как кубическая, гексагональная, тетрагональная и другие. Форма кристаллической решетки зависит от типа атомов или молекул, их размеров, химической связи и других факторов.
Различные свойства веществ, такие как твёрдость, прозрачность, проводимость и многие другие, определяются структурой и размерами кристаллической решетки. Например, кристаллы, имеющие большие размеры, могут быть прозрачными, в то время как кристаллы с разрезами и дефектами в решетке могут иметь мутный или непрозрачный вид.
Кристаллическая решетка также влияет на химические свойства вещества. Различные расположения атомов или молекул в решетке могут способствовать образованию химических связей или взаимодействию с другими веществами, что приводит к возникновению новых веществ или изменению их химических свойств.
Таким образом, формирование кристаллической решетки является важным фактором, определяющим различные свойства веществ. Изучение структуры и свойств кристаллической решетки помогает понять и объяснить поведение и взаимодействие разных веществ в природе и в лабораторных условиях.
Типы связей между атомами
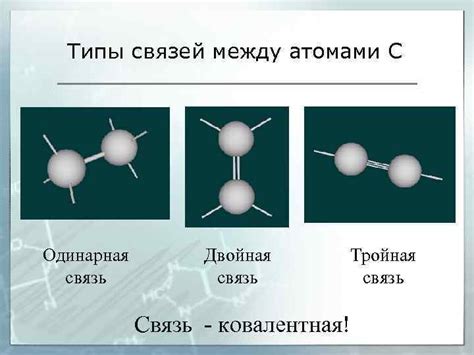
Свойства вещества в значительной степени зависят от типов связей между атомами. Ниже представлены наиболее распространенные типы связей, которые могут существовать между атомами:
- Ионные связи: Ионные связи образуются между атомами с противоположными электрическими зарядами. Один атом отдает электрон(ы), образуя положительный ион, а другой атом принимает электрон(ы), образуя отрицательный ион. Эти ионы притягиваются друг к другу силой электростатического притяжения, образуя ионное соединение. Примерами веществ с ионными связями являются соли, такие как хлорид натрия (NaCl).
- Ковалентные связи: Ковалентные связи образуются, когда два атома делят одну или несколько пар электронов. Эта связь является сильной и создает молекулярную структуру вещества. Примерами веществ с ковалентными связями являются кислород (O2) и вода (H2O).
- Металлические связи: Металлические связи образуются между атомами в металлах. В этом случае электроны свободно перемещаются между металлическими атомами, образуя облако свободных электронов. Это придает металлам такие свойства, как электропроводность и хорошую теплопроводность. Примером вещества с металлической связью является железо (Fe).
- Водородные связи: Водородные связи образуются между атомом водорода и электроотрицательным атомом, обладающим свободной парой электронов. Водородные связи играют важную роль в определении физических свойств многих веществ, таких как вода (H2O).
Эти различные типы связей между атомами влияют на такие свойства вещества, как температура плавления, твердость, электропроводность и растворимость. Изучение и понимание этих связей помогает ученым предсказывать и объяснять свойства разных веществ и разрабатывать новые материалы для различных целей.
Диссоциация и ионизация

Диссоциация - это процесс, при котором молекулы вещества распадаются на ионы под воздействием физических или химических факторов. При этом, ионы образуются из атомов или групп атомов, составляющих молекулу. Примером диссоциации может служить растворение хлористого натрия (NaCl) в воде, когда молекулы NaCl распадаются на ионы натрия (Na+) и хлора (Cl-).
Ионизация - это процесс, при котором молекулы вещества разрываются на ионы под воздействием электрического поля. В отличие от диссоциации, ионизация происходит при наличии заряженных частиц и взаимодействии под действием электрических сил. Примером ионизации может служить действие электрического тока на электролитический раствор, когда ионы образуются из молекул под влиянием электрического разряда.
Диссоциация и ионизация существенно определяют свойства вещества. Они влияют на реактивность, электропроводность, растворимость и другие химические и физические свойства веществ. Понимание этих процессов позволяет более глубоко исследовать и объяснять поведение различных веществ в разных условиях.
Взаимодействие с окружающей средой
Некоторые вещества могут быть растворимыми в воде, в то время как другие не смешиваются с ней и остаются нерастворимыми. Это обусловлено взаимодействием между молекулами вещества и молекулами воды, а также силами притяжения и отталкивания, действующими между ними.
Окружающая среда также может оказывать влияние на изменение состояния вещества. Например, возможно изменение температуры, давления или pH-значения раствора, что может привести к изменению свойств вещества.
Реакция вещества с окружающей средой может вызывать его окисление, коррозию или трансформацию в другое вещество. Это происходит, когда вещество вступает в химическую реакцию с кислородом, влагой, светом или другими веществами в окружающей среде.
Также важную роль взаимодействия с окружающей средой играют физические свойства вещества, такие как плотность, теплопроводность, электропроводность и т. д. Они могут влиять на то, как вещество взаимодействует с теплом, электричеством или другими формами энергии.
Итак, взаимодействие с окружающей средой является одним из факторов, определяющих свойства вещества. Оно зависит от его химического состава, структуры и физических свойств, а также от условий окружающей среды, в которой оно находится.



